
Категории:
ДомЗдоровьеЗоологияИнформатикаИскусствоИскусствоКомпьютерыКулинарияМаркетингМатематикаМедицинаМенеджментОбразованиеПедагогикаПитомцыПрограммированиеПроизводствоПромышленностьПсихологияРазноеРелигияСоциологияСпортСтатистикаТранспортФизикаФилософияФинансыХимияХоббиЭкологияЭкономикаЭлектроника
Порядок действий при проведении измерений изотерм сжатия
Краткие теоретические сведения
Развитие наноэлектроники возродило новую волну интереса к технологии и пленкам Ленгмюра-Блоджетт (ЛБ). привлекают, прежде всего, специфические возможности технологии ЛБ, позволяющие обеспечивать контролируемое последовательное перенесение отдельных мономолекулярных слоев (МС) с поверхности раздела жидкость-воздух на поверхность твердых тел, и создавать разнообразные новые наноматериалы. При создании как монослоев, так и пленок ЛБ принимаются во внимание и реализуются принципы супрамолекулярной химии, основанные на “самосборке” молекул с заданными строением, функциональными свойствами и геометрическим расположением на подложке, решаются проблемы межмолекулярного информационного обмена (обеспечение взаимодействия молекул с ближним и дальним окружением, выстраивание функциональных связей, адресный доступ к молекуле или фрагменту), а также технологические задачи (управление свойствами объектов “наномира” средствами “макромира”). Вызывают интерес перспективы практического применения пленок ЛБ в элементах микро- и наноэлектроники.
Для получения пленок ЛБ с заданными свойствами важно знать закономерности и особенности формирования МС, принципы управления их химическим составом, а также условия, при которых в монослое могут протекать те или иные физические процессы или химические реакции. В связи с этим большое значение имеют исследования, связанные с формированием МС на поверхности водной субфазы, которые позволяют судить о его состоянии, закономерностях формирования и реализации последующего получения наноразмерных пленок с набором необходимых электрофизических, оптических, электрохимических или химических свойств.
Напомним некоторые понятия и термины физики и химии поверхности.
Как известно, на молекулу вещества, находящуюся внутри объемной жидкой фазы, действуют силы притяжения[1]) со стороны всех окружающих ее молекул. Таким образом, в объеме раствора влияние на молекулу сил, действующих со стороны других молекул, усредняется, т.е. межмолекулярные взаимодействия по всем направлениям будут равноправными. Если же молекула находится на поверхности жидкости, то межмолекулярные взаимодействия со стороны газовой фазы будут практически отсутствовать, а со стороны жидкости останутся. В связи с этим, на молекулу, находящуюся на поверхности, действует сила, направленная внутрь жидкости, т.е. в поверхностном слое поле межмолекулярных сил в сравнении с объемной жидкой фазой будет ненасыщенным.
Следовательно, для перехода молекулы из объема раствора в поверхностный слой нужно совершить некоторую работу, связанную с разрывом части межмолекулярных связей и изменением поверхностной энергии (W) системы молекул. Для характеристики указанного состояния системы вводят понятие поверхностного натяжения s, определяемого через избыточную тангенциальную силу на единицу длины периметра поверхности (рис. 1.1):
 , (1.1)
, (1.1)
W – поверхностная энергия;
S – площадь поверхности;
F – модуль силы поверхностного натяжения, действующей на границу поверхностного слоя;
l – длина границы поверхностного слоя (периметр).

Рис. 1.1. Поверхностное натяжение.
Поверхностное натяжение может меняться в зависимости от природы жидкости, температуры, давления, кислотности раствора, присутствия различных неорганических и органических веществ в составе жидкости. Необходимо отметить, что молекулы многих органических соединений адсорбируются на границе раздела вода-воздух и, как правило, уменьшают поверхностное натяжение, так как они менее полярны, чем молекулы воды. Такие вещества называют поверхностно-активными веществами (ПАВ). При этом, поверхностное натяжение будет определяться природой, числом таких веществ в растворе и концентрацией каждого из них, т. е. поверхностная активность будет проявлением совокупности всех факторов. Поверхностная активность характеризуется производной -¶s/¶c, где с – объемная концентрация вещества. Если эта величина больше нуля, то вещество поверхностно-активно, если меньше, то поверхностно-инактивно.
При адсорбции ПАВ на поверхности раздела наблюдается удивительное явление, при котором интенсивные величины (концентрации веществ) в самопроизвольном процессе не выравниваются как обычно, а, наоборот, расходятся, поскольку концентрация ПАВ на поверхности раздела существенно больше их концентрации в объеме жидкости. Изменение концентраций компенсируется изменением поверхностного натяжения.
Номенклатура этих веществ весьма обширна. Молекулы ПАВ обычно содержат неполярный гидрофобный углеводородный радикал и полярную гидрофильную группу, расположенных на разных концах молекулы, т.е. они дифильны. В качестве примера можно привести вещества из классов жирных кислот, длинноцепочных сульфокислот, солей полиамидокислот (рис. 1.2). Следует подчеркнуть, что поверхностная активность – не свойство вещества самого по себе, а его свойство в данной системе (растворителе), которое может зависеть и от концентрации вещества в растворе, т.е. понятие поверхностной активности относительно. Чем сильнее вещество адсорбируется на поверхности жидкости, тем выше его поверхностная активность и больше уменьшение поверхностного натяжения.
Разность поверхностного натяжения чистой воды (s0 = 72,88 мН/м при t = 20 °C) и установившегося поверхностного натяжения s при внесении ПАВ на поверхность водной субфазы называют поверхностным давлением (p):
 , (1.2)
, (1.2)
Рассмотрим МС органических молекул на границе раздела вода-воздух как квазидвумерную термодинамическую систему, которая, как и трехмерная, может находиться в одном из фазовых состояний: газообразном, жидком, твердом.
Для формирования МС на поверхность водной субфазы вносят небольшой объем раствора молекул ПАВ (V) в легколетучем растворителе заданной объемной концентрации (с). Зная значения V и с, а также геометрические размеры ванны b и l при любом положении барьера, можно рассчитать площадь ванны, приходящуюся на одну молекулу ПАВ (А):
 , (1.3)
, (1.3)
где NA – постоянная Авогадро.

Рис. 1.2. Примеры химических веществ, обладающих свойствами ПАВ
а) – октадецилдиметиламмониевая соль полипиромеллитамида;
б) – олеиновая кислота;
в) – арахиновая кислота;
г) – стеариновая кислота;
д) – гексадецилсульфат натрия.
Изменяя площадь ванны с помощью подвижного барьера, и фиксируя, таким образом, значения p, рассчитывают А и получают зависимость p от А при постоянной температуре – изотерму сжатия, которая содержит информацию об универсальных взаимодействиях, происходящем в монослое, а также о специфике поведения амфифильной (дифильной) молекулы при изменении поверхностного давления.
При изменении площади, занимаемой монослоем, в нем происходит перестройка молекул: смена конформации, ориентации и взаимного расположения молекул. При этом можно говорить о смене фазовых состояний квазидвумерной системы молекул, каждое из которых характеризуется набором термодинамических параметров, связанных с реологическими параметрами (вязкостью, сжимаемостью, модулем сжатия и пр.) и параметрами кристаллической структуры.
Для небольших концентраций ПАВ на поверхности водной субфазы (как видно из рис. 1.3) межмолекулярные расстояния таковы, что латеральным[2]) взаимодействием можно пренебречь, либо при высоких температурах монослой можно сравнивать с двумерным идеальным газом, подчиняющимся уравнению:
 , (1.4)
, (1.4)
где π – выражается в Н/м; A – выражается в м2.
С увеличением поверхностного давления π в монослое (когда латеральное взаимодействие становится ощутимым) для описания можно использовать двумерный аналог уравнения Ван-дер-Ваальса:
 , (1.5)
, (1.5)
где a – коэффициент, учитывающий поправку к давлению из-за межмолекулярного взаимодействия; b- минимальная площадь, занимаемая молекулой в сплошном слое.
При более низкой температуре увеличение поверхностного давления приводит к переходу газообразной фазы в двумерную изотропную жидкую фазу. Переход сопровождается изменением сжимаемости монослоя δ и модуля сжатия c, которые рассчитывают по формулам:
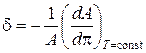 и
и  , (1.6)
, (1.6)
где  - приращение площади,
- приращение площади,  - приращение давления.
- приращение давления.
Дальнейшее уменьшение площади поверхности приводит к резкому увеличению давления из-за низкой сжимаемости твердой фазы, состоящей из ориентированных молекул ПАВ, поэтому при продолжении сжатия монослой не выдерживает нагрузки и ломается: происходит наслоение монослоев с образованием складок. Такое явление называют коллапсом монослоя, а давление, достигаемое в МС, называют давлением коллапса pк. При дальнейшем сжатии МС значения поверхностного давления меняются слабо, а в некоторых случаях наблюдается даже его спад.







Анализ изотермы сжатия позволяет определить такие важные параметры как предельную площадь на одну молекулу А0 (рис. 1.4), давление переноса монослоя на твердую подложку pн.
Предельная (или минимальная удельная) площадь А0 – площадь, занимаемая одной молекулой или звеном полимера в плотно упакованном состоянии, рассчитывается экстраполяцией линейного участка p – А изотермы до пересечения с осью абсцисс (при p = 0), т.е. это размер молекулы без нагрузки). Знание А0 дает возможность оценить поверхностную концентрацию молекул на подложке.

Рис. 1.4. Изотерма сжатия и параметры монослоя.
Не менее важным для анализа изотерм является определение первой и второй производных:
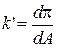 и
и 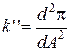 . (1.7)
. (1.7)
К примеру, если k'' = 0 и k' = kmin, то удельная площадь принимает минимальные значения А0 = Аmin, при этом упаковка молекул в МС становится плотной. С физической точки зрения, это позволяет судить об эффективности контакта молекул друг другом, когда углеводородные цепи (УЦ) молекул начинают «соприкасаться» по всей длине.
По величине k' можно оценивать упругость МС еще до формирования твердокристаллического состояния. При этом следует учитывать, что одновременно с увеличением взаимодействия при сближении молекул происходит не только вытеснение воды из межмолекулярного пространства, но и переход молекул в вертикальное положение[3]), что с точки зрения термодинамики может трактоваться как фазовый переход I рода.
При формировании МС (к примеру, жирных кислот) на поверхности водных растворов неорганических солей, катионы металлов могут замещать катион водорода (протон) в гидрофильгых группах молекул, составляющих МС, в соответствие с уравнением: Меx+ + x·HStr « MeStrx + H+ (где Str – стеариновая кислота). При увеличении количества молекул солей жирных кислот увеличивается удельная площадь в жидкоконденсированном состоянии. Для таких монослоев относительная доля (zp) молекул жирной кислоты, перешедших в соль может быть рассчитана по формуле:
 , (1.8)
, (1.8)
где Aa, Am и As– величины удельных площадей для монослоев кислоты, соли и смешанного монослоя, соответственно.
Эти величины получаются экстраполяцией до пересечения с осью абсцисс линейных участков изотерм сжатия, соответствующих жидкоконденсированному состоянию (для расчета Aa и Am) и твердокристаллическому состоянию (для расчета As).

| 
|

| Рис. 1.5. Установка KSV Nima LB. |
Экспериментальная часть
Цель работы состоит в формировании и исследовании монослоев на поверхности жидкой субфазы: дистиллированной воды, растворов неорганических солей.
Проведение измерений
Формирование ленгмюровских монослоев и исследование их поведения при сжатии, а так же перенос монослоев на твердые подложки осуществляется на установке KSV Nima LB Trough, представленной на рис. 1.5.
Описание установки
Установка KSV Nima LB для получения пленок по методу Ленгмюра–Блоджетт приведена на рис. 1.6. Она состоит из ленгмюровской ванны, которая включает в себя рабочую зону ванны (3), подвижные барьеры (2), весы вильгельми (4) и блока ручного управления.

Рис. 1.6. Общая схема установки KSV Nima LB
1 – механизм движения барьеров; 2 – подвижные барьеры; 3 – корыто; 4 – датчик поверхностного давления; 5 – дипер; 6 – блок ручного управления.
В рабочей зоне, располагающейся между подвижными барьерами области корыта (3), с помощью подвижного барьера (2) на поверхности воды формируется монослой молекул поверхностно-активных веществ. Углубление в рабочей зоне (3) служит для погружения или вывода подложки из воды при нанесении пленок ЛБ. Для погружения и вывода подложки из воды используется дипер (5). Управление движением дипера и подвижных барьеров осуществляется при помощи блока ручного управления. Датчиком измерения поверхностного давления являются весы Вильгельми.
Управление процессом получения монослоев и их переноса на твердые подложки осуществляется при помощи персонального компьютера с установленным пакетом программного обеспечения- KSV Layer Builer.Считать показания датчика поверхностного натяжения.
1.Сжать монослой, сдвинув барьер на некоторую величину (0,5 см), производится изменение положения подвижного барьера в течение 1 секунды со скоростью 5∙10-5 м2×с-1 при этом подвижный барьер сдвигается приблизительно на 5 мм. Далее следует 15 секундная пауза, необходимая для релаксации монослоя, по окончанию которой производится запись поверхностного натяжения, (возможно изменение времени релаксации монослоя в зависимости от исследуемого вещества и порядок записи поверхностного натяжения).
Краткие теоретические сведения
Формирование монослоев (МС) – сложный процесс, зависящий от многих факторов. В связи с тем, что молекулы, составляющие МС, взаимодействуют друг с другом и с молекулами воды (взаимодействие с молекулами газовой фазы считается пренебрежимо малым и в данном случае не рассматривается), МС, в зависимости от условий, может претерпевать различные изменения (рис. 2.1).

Рис. 2.1. Молекулярные перестройки в МС.
Варианты молекулярных перестроек в МС: а) – г) – за счет изменения взаимного расположения молекул, д) – за счет изменения ориентации углеводородной цепи и перегибов на поворотах связей в углеводородной цепи, е) – за счет образования объемной фазы (мультислоя, коллапса), ж) – за счет процессов, протекающих в МС при активном участии субфазы.
Изменение числа молекул в МС связано чаще всего с их уходом с поверхности в воду за счет растворения или выходом на поверхность воды из объема при их адсорбции, при изменении условий внешней среды или протекании химических реакций в монослое. Количество молекул меняется также и при формировании объемной фазы МС (коллапсе пленки) в процессе его сжатия, т.е. при локальных переходах в объемную фазу с образованием двойного, тройного слоя и др. или высвобождением молекул из таких фрагментов и переходом в монослой в процессе распрямления коллапсированных фрагментов (рис. 2.1).
Для понимания механизмов, приводящих к трансформации монослоя, исследуют его стабильность: зависимость p (при S = const) и S (при p = const) от времени при фиксированной площади или поверхностном давлении, соответственно. Кроме чисто научного интереса такие исследования важны с практической точки зрения. Знание стабильности мономолекулярного слоя позволяет прогнозировать поведение МС при его формировании и переносе на поверхность твердой подложки, характеризует возможность поддержания необходимой плотности монослоя в процессе получения, а, следовательно, предполагаемые параметры кристаллической структуры пленки Ленгмюра-Блоджетт (ПЛБ), а также воспроизводимость процесса при переносе каждого монослоя на твердую поверхность.
Стабильность монослоев можно повысить уменьшением температуры субфазы, введением в монослой или субфазу стабилизирующих добавок, а для ионогенных соединений – изменением рН, используя в качестве субфазы растворы электролитов*). Рассмотрим явления, описывающие динамическое поведение монослоев.
Важную информацию можно получить при изучении зависимости поверхностной концентрации ПАВ в монослое, сформированном при различных условиях, от времени.
 , (2.1)
, (2.1)
где Г – адсорбция; А0(t) – удельная площадь монослоя.
К сожалению, эта зависимость не всегда известна. Чаще всего известна концентрация изначально внесенного на поверхность жидкой субфазы раствора ПАВ в легколетучем растворителе, но, вследствие массообмена с прилегающей объемной фазой, коллапсом и другими взаимодействиями, величина Г(t) может сильно измениться. Что касается прямого измерения зависимости поверхностное давление-время, на первый взгляд изменение p может быть объяснено следующими процессами: (1) изменением Г и (2) изменением взаимосвязи между p и Г.
При отсутствии химических или структурных изменений, а также при незначительных изменениях реологии, можно проводить упрощенное рассмотрение π(t).
Таким образом, Г можно рассматривать как функциональную зависимость от общей площади поверхности А и времени t:
 , (2.2)
, (2.2)
и  , (2.3)
, (2.3)
где Г может быть представлена как n/А, где n – количество молей ПАВ на поверхности (т.е. имеет смысл поверхностной концентрации).
Таким образом, получаем:
 . (2.4)
. (2.4)
Здесь  можно представить в виде:
можно представить в виде:
 , (2.5)
, (2.5)
Таким образом, изменение концентрации в формуле (2.5) складывается из следующих слагаемых: Â1 (изменение концентрации из-за утечки молекул через границы), Â2 (изменение концентрации в результате перехода в объем соседней субфазы – воды, воздуха), Â3 (изменение концентрации за счет коллапса, процессов обмена молекулами квазидвумерной и трехмерной фазы), Â4 (изменение концентрации за счет обмена молекулами в квазидвумерной фазе – между разреженными и конденсированными участками монослоя).
Если монослой считать однородным и ограниченным непроницаемым по длине всей границы барьером, то первый член справа можно опустить; если же акцент делается только на монослой, подвергающийся сжатию, исчезнет последний элемент и формула (2.5) может быть записана в виде:
 , (2.6)
, (2.6)
где jc – коэффициент потери площади монослоя при коллапсе (переходе из монослойного состояния в мультислойные складки и наоборот);
jd - коэффициент потери площади монослоя при растворении;
je - коэффициент потери площади монослоя при испарении.
Подставляя (2.6) в (2.4), получаем:
 . (2.7)
. (2.7)
Предполагая существование равновесного состояния при постоянной температуре, поверхностное давление выражается как:
 (2.8)
(2.8)
и
 . (2.9)
. (2.9)
Эмпирически было показано, что в формуле (2.9) экспериментальные данные (площадь монослоя) можно представить как функцию от времени при постоянном поверхностном давлении, что весьма удобно для выражения jc:
 . (2.10)
. (2.10)
Величина Г определяется для каждого конкретного значения p (для известных величин площади поверхности и количества вносимого на нее вещества), а jd и je, могут быть определены отдельно.
Экспериментальная часть
Проведение измерений
Формирование ленгмюровских монослоев и их перенос на твердые подложки осуществляется на установке KSV Nima LB Trough, представленной на рис. 1.5 в лабораторной работе № 1 «Исследование монослоев поверхностно-активных веществ на водной поверхности». Там же приведены описание установки, инструкция по работе с ней и подготовительные процедуры (см. п.п. 1 – 9 раздела «Порядок действий при проведении измерений изотерм сжатия»лабораторной работы № 1).
Порядок проведения измерений:
1. Включите установку KSV Nima LB Trough переключив тумблер, расположенный на задней крышке блока ручного управления (6) в положение ВКЛ.
2. Запустите программу управления установкой KSV Nima LB Trough, кликнув на пиктограмму KSV Nima LB, располагающуюся на рабочем столе. Откроется диалоговое окно, представленное на рисунке 1.7.

Рис.1.7. Вид окна программного пакета KSV Layer Builder.
Нажмите кнопку Manual Control, которая служит для активации ручного управления дипером (5) и подвижных барьеров (2) при помощи блока ручного управления (6). Откроется окно, представленное на рисунке 1.8.
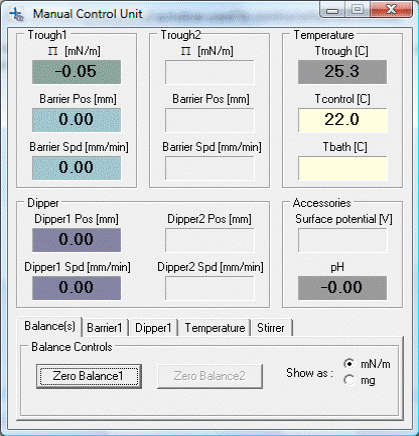
Рис.1.8. Вид окна Manual Control.
3. Налейте 250 мл деионизованной воды в рабочую зону ванны (3), при этом старайтесь, чтобы уровень мениска совпадал с высотой стенок ванны. Повесьте пластину Вильгельми на крепление, расположенное на датчике поверхностного давления (4). Убедитесь, что происходит касание пластиной воды, в случае отсутствия касания опустите датчик поверхностного давления, используя регулировочные винты (4.1, 4.2, 4.3), расположенные под датчиком. Подождите, около 5 минут, пока давление (окно Manual Control Unit) Π не перестанет падать, после чего перейдите во вкладку Balance(s) и нажмите кнопку Zero Balance, обнулив таким образом показания датчика давления.
4. Нажмите кнопку начало нового эксперимента.
 - начала нового эксперимента
- начала нового эксперимента
Откроется окно, вид которого, представлен на рисунке 1.9.

Рис.1.9. Начало нового эксперимента.
Нажмите кнопку ISO, для начала эксперимента по получению изотермы сжатия. Откроется диалоговое окно, представленное на рисунке 1.10.
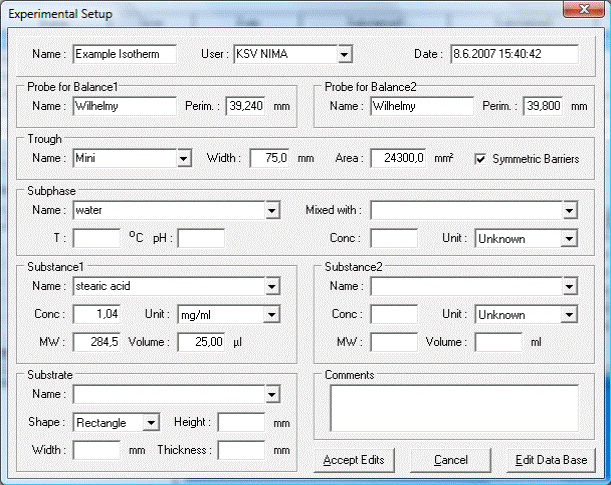
Рис.1.10. параметры эксперимента по получению изотермы сжатия.
В поле Name необходимо ввести название эксперимента. В поле User выбрать из выдвигающегося списка пользователя. В поле Suphase в пункте Name выберите вещество, которое будет использовано в качестве растворителя в субфазе. При использовании в качестве субфазы раствора в поле Mixed With выберите второй компотент раствора. В поле Substance в пункте Name выберите используемый ПАВ. В поле Conс укажите концентрацию ПАВ, в поле Unit укажите единицы измерения концентрации. В поле Volume введите объем наносимого ПАВ. В поле комментарии, при необходимости, укажите дополнительные параметры эксперимента. Нажмите кнопку Accept Edits. После нажатия указанной кнопки откроется окно, представленное на рисунке 1.11.
4.1. Наберите в шприц-дозатор количество ПАВ, указанное в графе Volume.
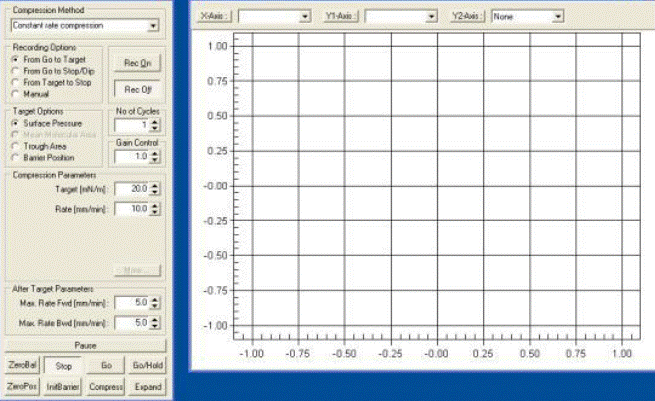
Рис.1.11. Управление экспериментом по получению изотермы сжатия.
В выпадающем списке Compression Method выберите нужный тип сжатия барьеров из представленных- Constant rate compression, Linear compression, Rate relative to remaining area, Oscillating barriers.
Constant rate compression- постоянная скорость движения барьеров.
Linear compression- скорость движения барьеров изменяется в зависимости от скорости изменения поверхностного давления.
Rate relative to remaining area- в зависимости от изменения рабочей площади от времени изменяется и скорость движения барьеров. При уменьшении рабочей площади происходит пропорциональное уменьшение скорости движения барьеров.
Oscillating barriers- барьеры совершают синусоидальные колебания, нулевой отметкой для которых является точка, указанная в параметрах цели.
В пункте меню Target Options выберите условие завершения эксперимента
Surface Pressure- максимальное давление
Mean Molecule Area- площадь, приходящаяся на одну молекулу
Trough Area- остающаяся рабочая площадь
Barrier Position- позиция барьеров
Для начала процесса изучения стабильности монослоя необходимо указать давление, при котором будет исследоваться стабильность монослоя. Значение давления могут быть получены при анализе изотерм сжатия, полученных в лабораторной работе 1. Для фиксирования стабильности монослоя в Recording Options выберите пункт From target to stop/dip.
В окне Compression Method введите параметры движения барьеров и параметры цели, указанной выше:
Target- параметры цели (т.е. требуется указать точку до которой будет производиться сжатие- до указанного давления, расстояния или площади)
Rate- скорость движения барьеров
Также для измерения стабильности монослоя необходимо указать скорость, с которой будет производиться сжатие монослоя для поддержания заданного уровня давления- для этого необходимо установить параметры движения барьеров после достижения цели (After target parameters):
Max. Rate FWD- максимальная скорость сжатия барьеров
Max. Rate BWD-максимальная скорость разжатия барьеров
В окне Waite Before Go укажите время, отводимое на выветривание растворителя с поверхности субфазы.
Необходимо изменить координаты, в которых будет производиться запись процесса- для этого необходимо рядом с кнопками X-axis Y-axis выбрать из выпадающих списков новые координаты- время и изменение площади, приходящейся на одну молекулу, соответственно.
После указания необходимых параметров нажмите кнопку GO/HOLD, после чего через время, указанное в окне Waite Before Go, начнется движение барьеров с заданной скоростью.
5. По достижении цели, активируется режим поддержания заданного давления.
6. По окончании движения барьеров, окно Trough Controls автоматически закроется. Перед вами останется окно с зависимостью движения барьеров от времени. Изотерма сохраняется автоматически, для извлечения данных необходимо нажать на кнопку Browse Experiment после чего откроется окно, представленное на рисунке 1.12.
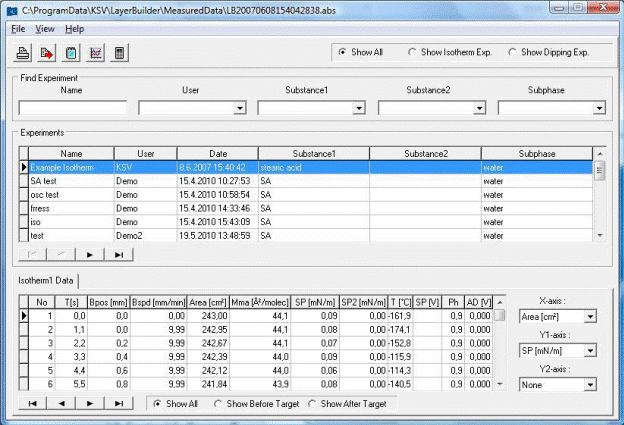
Рис.1.12 Окно выбора эксперимента.
Выберите нужный эксперимент, дважды кликнув левой кнопкой мыши по нужному элементу списка, из списка, после чего, кликнув правой кнопкой мыши, в появившемся окне выберите пункт Copy Data to ClipBoard, после чего откройте любой текстовый редактор и вставьте полученные данные из буфера обмена ПК.
6. Закройте окно Запуска нового эксперимента.
7. Произведите очистку ванну, для чего разведите барьеры на максимально возможное расстояние, используя соответствующую клавишу на блоке ручного управления (). После этого, используя нанос, соберите воду из рабочей части ванны (). Протрите поверхность ванны, используя ватку, смоченную хлороформом. Налейте в ванну немного воды (50-100мл).
8. Закройте окно Manual Control, закройте главное меню программы.
9. Выключите установку, используя тумблер включения на задней стороне блока ручного управления.
10. Данные занести в электронную таблицу (см. рис. 1.13). Рассчитать основные параметры монослоев по формулам 1.2, 1.3, 1.6, 1.8[5]).
11. Построить график π-А зависимости и результаты эксперимента обсудить с преподавателем.
Завершить работу на установке, следуя рекомендациям, приведенным в п.п. 11, 12 раздела «Порядок действий при проведении измерений изотерм сжатия» лабораторной работы № 1.
Контрольные вопросы:
1. Что понимается под стабильностью монослоя, сформированного на поверхности жидкой субфазы.
2. Методы исследования стабильности, особенности модельного подхода и экспериментальной реализации каждого из методов.
3. Критерии выявления преимущественного механизма релаксации монослоя.
4. Приведите примеры как изменение механизмов релаксации может быть связано с изменениями условий проведения эксперимента.
Список использованных источников:
1. Richard D. Smith, John C. Berg. The Collapse of Surfactant Monolayers at the Air-Water Interface // J. Colloid Interface Sci. – 1980. – Vol. 74, No. 1. – P. 273-286.
2. The dissolution of myristic acid monolayers in water / O. Albrecht, H. Matsuda, K. Eguchi, T. Nakagiri // Thin Solid Films. – 1999. – V. 338. – P. 252-264.
3. Адамсон А. Физическая химия поверхностей // Пер. с англ. под ред. З. М. Зорина и В. М. Муллера. М: Мир. – 1979. – 568 с.
4. Арсланов В.В. Полимерные монослои и пленки Ленгмюра-Блоджетт. Влияние химической структуры полимера и внешних условий на формирование и свойства организованных молекулярных ансамблей // Успехи химии. – 1994. – Т. 63, № 1. – С. 3.
Лабораторная работа № 3 «Перенос монослоев на твердые подложки. Способы переноса. Коэффициент переноса»
Краткие теоретические сведения
К настоящему времени существует несколько обзоров в отечественной литературе, в которых рассматриваются вопросы «молекулярного зодчества». Этот термин, введенный Л. М. Блиновым, наряду с термином «молекулярная архитектура» используется, когда речь идет о создании молекулярных ансамблей с заданными свойствами – структурными и функциональными. Оба эти понятия давно вошли и в лексикон специалистов, и даже в учебные пособия для студентов вузов. Они относится к тому разделу электроники, в котором в качестве функциональных элементов выступают отдельные молекулы, группы молекул или такие крупные объекты, как моно- и мультислойные пленки.
В то время, когда появился первый интерес к использованию органических веществ как новых материалов в электронике, речь, чаще всего, шла о достаточно больших количествах таких соединений. Постепенно микроэлектроника органических веществ (органическая микроэлектроника) становилась «молекулярной микроэлектроникой» в полном смысле этого слова. Вместе с тем на данный момент в этой научно-технической области основными актуальными проблемами по-прежнему остаются следующие:
— сборка молекул с заданным строением, функциональными свойствами и определенным расположением на твердой или гибкой подложке*) (проблема архитектурно-технологическая);
— обеспечение взаимодействия с соседними молекулами (ближним молекулярным окружением), установление функциональных связей (проблема межмолекулярного информационно-энергетического обмена);
— обеспечение адресного доступа к молекуле или ее отдельному фрагменту (проблема эффективного интерфейса между микро- и макрообъектами, или, другими словами, проблема управления свойствами объектов “наномира” средствами “макромира”).
Уверенность в возможности решения «архитектурно-технологической» проблемы обусловлена многими объективными причинами, в том числе успехами в развитии химической науки и техники точных измерений. Вместе с этим очень важную роль сыграла разработка методов и инструментов для манипулирования микро- и наноразмерными объектами (световых пинцетов, атомно-силовых микроскопов-манипуляторов). Более того, развитие физического и химического инструментария и методов позволит продвинуться в решении и других задач. Одним из возможных путей решения поставленных проблем является развитие технологии Ленгмюра-Блоджетт, которая позволяет «работать» с отдельными монослоями молекул.
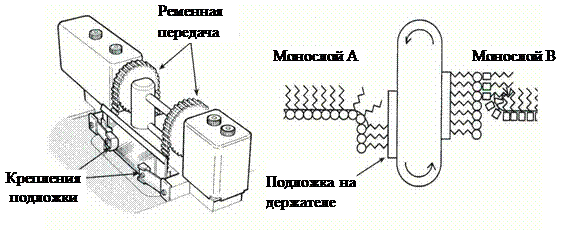
Впервые возможность переноса монослоя на твердую подложку осуществил Ирвинг Ленгмюр. Катарина Блоджетт внесла существенные изменения в технику переноса: была усовершенствована установка для формирования, исследования и переноса монослоев — ленгмюровская ванна, что позволило получать моно- и мультислойные пленки на твердых подложках. В настоящее время техника продолжает совершенствоваться. К примеру, проводят исследования монослоев и вместе с тем занимаются разработками новых ленгмюровских установок (рис. 3.1) такие крупные фирмы как KSV (Finland) и Nima Technology (UK).

|

| ||||||
| |||||||
| Рис. 3.1. Ленгмюровская ванна (а) и диппер (манипулятор подложки) (б) фирмы KSV (Finland), схематичное изображение принципа нанесения альтернативных слоев, реализованный фирмой Nima Technology (UK) (в). |
Несмотря на развитие техники переноса многослоев и многообразие видов Ленгмюровских установок, суть метода ЛБ за почти столетнюю историю практически не изменилась. При его реализации, как правило, решаются следующие вопросы:
- выбор вещества, удовлетворяющего свойствам амфифильности (для получения стабильных монослоев на границе раздела вода-воздух), с требуемым набором функциональных свойств;
- выбор условий переноса монослоев с поверхности жидкой субфазы на поверхность твердой подложки и осуществление собственно переноса;
- последующая обработка полученной структуры (модификация вещества пленки ЛБ) и интегрирование полученной структуры с другими элементами микросхемы-микросборки (органическими, неорганическими структурами).
Как было показано ранее (лабораторная работа № 1), собственно процессу переноса монослоя предшествует стадия его исследования на поверхности водной субфазы. На этой стадии подбирают оптимальные условия, позволяющие получить определенные свойства и характеристики монослоя, которые затем воспроизводятся на стадии его переноса. В качестве таковых в первую очередь выступают фазовое состояние (в том числе предполагаемая кристаллическая структура), химический состав и стабильность монослоя в процессе всего времени переноса. Пример, типичной изотермы сжатия монослоя длинноцепочных жирных кислот (на примере арахиновой кислоты) приведен на рис. 1.3. (см. лабораторную работу № 1). Здесь же показаны касательные к участкам, которые соответствуют состояниям с плотной упаковкой в жидкоконденсированном и твердокристаллическом состояниях.
Кроме того, на первоначальных этапах нанесения могут оцениваться параметры, характеризующие кристалличность получаемой моно- и мультислойной пленки, её электрические свойства (диэлектрическая постоянная, электропроводность), а также оптические свойства, однородность по площади и толщине, силу сцепления с подложкой (адгезионные свой
Последнее изменение этой страницы: 2016-06-09
lectmania.ru. Все права принадлежат авторам данных материалов. В случае нарушения авторского права напишите нам сюда...