
Главная Случайная страница
Категории:
ДомЗдоровьеЗоологияРнформатикаРскусствоРскусствоКомпьютерыКулинарияМаркетингМатематикаМедицинаМенеджментОбразованиеПедагогикаПитомцыПрограммированиеПроизводствоПромышленностьПсихологияРазноеРелигияСоциологияСпортСтатистикаТранспортФизикаФилософияФинансыХимияХоббиРкологияРРєРѕРЅРѕРјРёРєР°Рлектроника
Значение постоянных валентностей некоторых элементов
| Валентность | Символы элементов |
| I | H, F, Ag, Na, K |
| II | O, Ca, Рњg, Ba, Zn |
| III | Рђl |
Для других атомов валентность** можно определить (вычислить) из химической формулы вещества. При этом нужно учитывать изложенное выше правило о химической связи. Например, определим валентность x марганца Mn по формуле вещества MnO2:
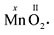
Общее число химических связей, образуемых одним и другим элементом (Mn и О), одинаково:
x · 1 = 4; II · 2 = 4. Отсюда х = 4, т.е. в этой химической формуле марганец четырехвалентен.
Рџ СЂ Р° Рє С‚ Рё С‡ Рµ СЃ Рє Рё Рµ РІ С‹ РІ Рѕ Рґ С‹
1. Если один из атомов в молекуле одновалентен, то валентность второго атома равна числу атомов первого элемента (см. на индекс!):

2. Если число атомов в молекуле одинаково, то валентность первого атома равна валентности второго атома:

3. Если у одного из атомов индекс отсутствует, то его валентность равна произведению валентности второго атома на его индекс:

4. В остальных случаях ставьте валентности «крест-накрест», т.е. валентность одного элемента равна индексу другого элемента:

Задание 1.2. Определите валентности элементов в соединениях:
CO2, CO, Mn2O7, Cl2O, P2O3, AlP, Na2S, NH3, Mg3N2.
П о д с к а з к а. Сначала укажите валентность атомов, у которых она постоянная. Аналогично определяется валентность атомных групп ОН, РО4, SО4 и др.
Задание 1.3. Определите валентности атомных групп (в формулах подчеркнуты):
H3PO4, Ca(OH)2, Ca3(PO4)2, H2SO4, CuSO4.
(Обратите внимание! Одинаковые группы атомов имеют одинаковые валентности во всех соединениях.)
Зная валентности атома или группы атомов, можно составить формулу соединения. Для этого пользуются следующими правилами.
• Если валентности атомов одинаковы, то и число атомов одинаково, т.е. индексы не ставим:

• Если валентности кратны (обе делятся на одно и то же число), то число атомов элемента с меньшей валентностью определяем делением:

• В остальных случаях индексы определяют «крест-накрест»:
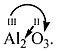
Задание 1.4. Составьте химические формулы соединений:
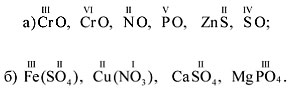
Вещества, состав которых отражают химические формулы, могут участвовать в химических процессах (реакциях). Графическая запись, соответствующая данной химической реакции, называется уравнением реакции. Например, при сгорании (взаимодействии с кислородом) угля происходит химическая реакция:
РЎ + O2 = CO2.
Запись показывает, что РѕРґРёРЅ атом углерода РЎ, соединяясь СЃ РѕРґРЅРѕР№ молекулой кислорода O2, образует РѕРґРЅСѓ молекулу углекислого газа РЎРћ2. Число атомов каждого химического элемента РґРѕ Рё после реакции должно быть одинаково. Рто правило – следствие закона сохранения массы вещества. Закон сохранения массы: масса исходных веществ равна массе продуктов реакции.
Закон был открыт в XVIII в. М.В.Ломоносовым и, независимо от него, А.Л.Лавуазье.
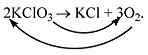
Выполняя этот закон, необходимо в уравнениях химических реакций расставлять коэффициенты так, чтобы число атомов каждого химического элемента не изменялось в результате реакции. Например, при разложении бертолетовой соли KClO3 получается соль KСl и кислород О2:
KClO3  KРЎl + Рћ2.
KРЎl + Рћ2.
Число атомов калия и хлора одинаково, а кислорода – разное. Уравняем их:
Теперь изменилось число атомов калия и хлора до реакции. Уравняем их:
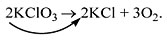
Наконец, между правой и левой частями уравнения можно поставить знак равенства:
2KClO3 = 2KРЎl + 3Рћ2.
Полученная запись показывает, что при разложении сложного вещества KClO3 получаются два новых вещества – сложное KСl и простое – кислород O2. Числа перед формулами веществ в уравнениях химических реакций называют коэффициентами.
При подборе коэффициентов необязательно считать отдельные атомы. Если в ходе реакции не изменился состав некоторых атомных групп, то можно учитывать число этих групп, считая их единым целым. Составим уравнение реакции веществ CaCl2 и Na3PO4:
CaCl2 + Na3PO4  ……………… .
……………… .
Рџ Рѕ СЃ Р» Рµ Рґ Рѕ РІ Р° С‚ Рµ Р» СЊ РЅ Рѕ СЃ С‚ СЊ Рґ Рµ Р№ СЃ С‚ РІ Рё Р№
1) Определим валентность исходных атомов и группы PO4:

2) Напишем правую часть уравнения (пока без индексов, формулы веществ в скобках надо уточнить):

3) Составим химические формулы полученных веществ по валентностям составных частей:

4) Обратим внимание на состав самого сложного соединения Ca3(PO4)2 и уравняем число атомов кальция (их три) и число групп РО4 (их две):
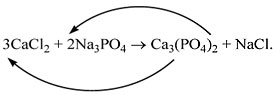
5) Число атомов натрия и хлора до реакции теперь стало равным шести. Поставим соответствующий коэффициент в правую часть схемы перед формулой NaCl:
3CaCl2 + 2Na3PO4 = Ca3(PO4)2 + 6NaCl.
Пользуясь такой последовательностью, можно уравнять схемы многих химических реакций (за исключением более сложных окислительно-восстановительных реакций, см. главу 7).
Типы химических реакций. Химические реакции бывают разных типов. Основными являются четыре типа – соединение, разложение, замещение и обмен.
1. Реакции соединения – из двух и более веществ образуется одно вещество:
Рђ + Р’  РђР’.
РђР’.
Например:
РЎР° + РЎl2 = CaCl2.
2. Реакции разложения – из одного вещества получаются два вещества или более:
РђР’  Рђ + Р’.
Рђ + Р’.
Например:
Ca(HCO3)2  CaCO3 + CO2 + H2O.
CaCO3 + CO2 + H2O.
3. Реакции замещения – реагируют простое и сложное вещества, образуются также простое и сложное вещества, причем простое вещество замещает часть атомов сложного вещества:
Рђ + Р’РҐ  РђРҐ + Р’.
РђРҐ + Р’.
Например:
Fe + CuSO4 = Cu + FeSO4.
4. Реакции обмена – здесь реагируют два сложных вещества и получаются два сложных вещества. В ходе реакции сложные вещества обмениваются своими составными частями:
РђР’ + XY  РђY + XР’.
РђY + XР’.
Например:
Al(OH)3 + 3HCl = AlCl3 + 3H2O.
Существуют и другие типы химических реакций.
Задание 1.5. Расставьте коэффициенты в схемах реакций:
Na + Cl2  NaCl,
NaCl,
NaHCO3  Na2CO3 + CO2 + H2O,
Na2CO3 + CO2 + H2O,
Fe + AgNO3  Fe(NO3)2 + Ag,
Fe(NO3)2 + Ag,
Fe(OH)3 + HCl  FeРЎl3 + H2O.
FeРЎl3 + H2O.
Задание 1.6. Расставьте коэффициенты и определите типы химических реакций:
Fe(OH)3  Fe2O3 + H2O,
Fe2O3 + H2O,
Al + H2SO4  Al2(SO4)3 + H2,
Al2(SO4)3 + H2,
HNO3 + Cu(OH)2  Cu(NO3)2 + H2O,
Cu(NO3)2 + H2O,
P + O2  P2O5.
P2O5.
Выводы по главе 1.Вещества состоят из молекул, молекулы состоят из атомов, атомы с одинаковым зарядом ядра относятся к одному и тому же химическому элементу.
Вещества бывают простые и сложные. Состав веществ показывают при помощи химических формул. Формулы веществ составляют, учитывая валентности составных частей. Запись химического процесса при помощи формул называется уравнением химической реакции. Химические реакции бывают разных типов: обмена, замещения, разложения, соединения и др.
Упражнения к главе 1
1. Выучите табл. 1. Проверьте себя, напишите химические символы: серы, цинка, олова, магния, марганца, калия, кальция, свинца, железа и фтора.
2. Напишите символы химических элементов, которые в формулах произносятся как: «аш», «о», «купрум», «эс», «пэ», «гидраргирум», «станнум», «плюмбум», «эн», «феррум», «це», «аргентум». Назовите эти элементы.
3. Укажите число атомов каждого химического элемента в формулах соединений:
Al2S3, РЎР°S, РњnРћ2, NH3, Mg3P2, SO3.
4. Определите, какие из веществ – простые, а какие – сложные:
Na2O, Na, O2, CaCl2, Cl2.
Прочитайте формулы этих веществ.
5. Выучите табл. 2. Составьте химические формулы веществ по известной валентности элементов и атомных групп:

6. Определите валентность химических элементов в соединениях:
N2O, Fe2O3, PbO2, N2O5, HBr, SiH4, H2S, MnO, Al2S3.
7. Расставьте коэффициенты и укажите типы химических реакций:
Р°) Mg + O2  MgO;
MgO;
Р±) Al + CuCl2  AlCl3 + Cu;
AlCl3 + Cu;
РІ) NaNO3  NaNO2 + O2;
NaNO2 + O2;
Рі) AgNO3 + BaCl2  AgCl + Ba(NO3)2;
AgCl + Ba(NO3)2;
Рґ) Al + HCl  AlCl3 + H2;
AlCl3 + H2;
Рµ) KOH + H3PO4  K3PO4 + H2O;
K3PO4 + H2O;
Р¶) CH4  C2H2 + H2.
C2H2 + H2.
* Существуют вещества, построенные не из молекул. Но об этих веществах речь пойдет позже (см. главу 4).
** Строго говоря, по нижеизложенным правилам определяют не валентность, а степень окисления (см. главу 7). Однако во многих соединениях числовые значения этих понятий совпадают, поэтому по формуле вещества можно определять и валентность.
Печатается с продолжением
