
Категории:
ДомЗдоровьеЗоологияИнформатикаИскусствоИскусствоКомпьютерыКулинарияМаркетингМатематикаМедицинаМенеджментОбразованиеПедагогикаПитомцыПрограммированиеПроизводствоПромышленностьПсихологияРазноеРелигияСоциологияСпортСтатистикаТранспортФизикаФилософияФинансыХимияХоббиЭкологияЭкономикаЭлектроника
Ферменти – біологічні каталізатори білкової природи.
Ферменти – це речовини білкової природи, які виробляються клітинами живих організмів і значно збільшують швидкість біохімічних процесів.
Біологічні каталізатори називають ферментами або ензимами.
„Ензим” (від гр.. en zime – в дріжджах), так само і „фермент” (від лат. Fermentum – закваска, fermentatio - бродіння)
Ферменти та неорганічні каталізатори підлягають загальним законам каталізу і характеризуються рядом подібних ознак:
- каталізують тільки ті реакції , які є енергетично можливими;
- не змінюють напрямку перебігу реакції;
- зменшують енергію активації, тим самим прискорюючи їх;
- не витрачаються в процесі реакції.
Проте ферменти характеризуються й особливими ознаками , які дають можливість відрізнити їх від звичайних неорганічних каталізаторів. Ці відмінності пов’язані з особливостями будови ферментів, які є складними макромолекулами білкової природи.
БУДОВА ФЕРМЕНТІВ
Розрізняють 4 рівня структурної організації ферментів (так само як і білкових молекул): первинна структура, вторинна структура, третинна структура, четвертинна структура.
Первинна структура– це лінійний ланцюг амінокислот сполучених між собою пептидними зв’язками, який розташований в певній послідовності.





 Вторинна структура– це різні типи упаковки поліпептидного ланцюга (розміщення в просторі первинної структури).
Вторинна структура– це різні типи упаковки поліпептидного ланцюга (розміщення в просторі первинної структури).
Типи упаковки вторинної структури: β-складчаста структура,
 α-спіраль
α-спіраль
Третинна структура–це розташування в просторі поліпептидного ланцюга (однієї субодиниці -білка) (розміщення в просторі вторинної структури)
Четвертинна структура- це розташування в просторі декількох субодиниць – білків в один білок) (розміщення в просторі третинної структури).
На рівні третинної і четвертинної структур фермент проявляє свою біологічну активність. І саме третинна і четвертинна структури забезпечують основні функції ферменту.
ВЛАСТИВОСТІ ФЕРМЕНТІВ як білків
Мають з білками однакові фізико-хімічні властивості: представляють собою глобулярні білки; розщеплюються при гідролізі на амінокислоти; володіють високою молекулярною масою; утворюють колоїдні розчини; погано кристалізуються; не дифундують через напівпроникні мембрани; є амфотерними електролітами; нестійкі до дії денатуруючи агентів: високих температур, солей важких металів, кислот, лугів; володіють антигенними властивостями, здатні до фракціонування; піддаються протеолітичному гідролізу.
ВЛАСТИВОСТІ ФЕРМЕНТІВ
Специфічність.
Оборотність (зворотність).
3. Активністьзалежить від:
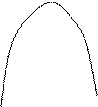
- температури (37Со) (див. Мал..3);
- рН (див. Мал.4);
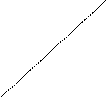
- концентрації ферменту (див. Мал.1);
- концентрації субстрату (див. Мал.2);
- концентрації продукту ферментативної реакції;
- активаторів та інгібіторів.
       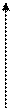     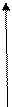    v
[F]
Мал. 1. Залежність швидкості ферментативної реакції від концентрації ферменту v
[F]
Мал. 1. Залежність швидкості ферментативної реакції від концентрації ферменту
| V --------------------------- [S] Мал. 2. Залежність швидкості ферментативної реакції від концентрації субстрату | v 20 37 60 T oC Мал. 3. Залежність швидкості ферментативної реакції від температури | v 2 4 6 8 рН Мал. 4. Залежність швидкості ферментативної реакції від рН середовища |
НОМЕНКЛАТУРА ФЕРМЕНТІВ
НАЗВУ ФЕРМЕНТІВ за тривіальною номенклатурою утворюють так:
1) спочатку називають субстрат, на який діє фермент;
2) потім тип реакції, яку він каталізує;
3) назву одного з продуктів реакції або речовин, які приймали участь в реакції;
4) і додають закінчення –аза.
Наприклад, назва ферменту, що каталізує, і додають закінчення –аза. Наприклад, назва ферменту, що каталізує окислення спиртів, утворюється так:
Алкоголь + дегідрогенізація + -аза = Алкогольдегідрогеназа
Для деяких давно відомих ферментів залишають раніше вживані традиційні назви, наприклад: пепсин (відкритий у шлунковому соку в 1836 р.), трипсин, каталаза, амілаза тощо.
| № класу | Назва класу | Тип реакції | Приклади ферментів |
| 1. | Оксидоредуктази | Окисно-відновні реакції | ЛДГ – лактатдегідрогеназа Каталаза, пероксидаза, цитохроми, ксантиноксидаза |
| 2. | Трансферази | Реакції міжмолекулярного перенесення різних функціональних груп від одного субстрату до іншого | -СН3 - метилтрансферази - NН2 – амінотрансферази (АлАТ – аланінамінотрансферази, АсАТ - аспартатамінотрансферази Na+, К+ -АТФ-ази – транспорт йонів Nа+, К+ крізь мембрану Гексокіназа |
| 3. | Гідролази | Розрив зв’язків з приєднанням води | Пептидний зв’язок – пепсин, трипсин, хемотрипсин; Ефірний зв’язок – амілаза, сахараза Складний зв’язок - естерази |
| 4. | Ліази | Розрив зв’язків у субстратах без приєднання води або окислення | Альдолази Піруватдекарбоксилази Декарбоксилаза. |
| 5. | Ізомерази | Реакції ізомеризації | Глюкозофосфатізомерази |
| 6. | Лігази (синтетази) | Реакції сполучення двох молекул з використанням енергії АТФ | Аспарагінсинтетаза |
МЕХАНІЗМ ДІЇ ФЕРМЕНТІВ
Особливість дії ферментів (порівняно з іншими каталізаторами) в тому, що вони викликають активацію молекул в нормальних фізіологічних умовах.
Для речовин, що беруть участь у ферментних реакціях, прийняті такі терміни та їх позначення:
S – субстрат – хімічна речовина або тип речовин, на яку діє фермент;
F (Е) –фермент або ензим – каталітично активна речовина, що прискорює реакцію
Р – продукт реакції
І – інгібітор каталітичної реакції – хімічні речовини, які гальмують або припиняють ферментативну реакцію
А – активатор - хімічні речовини, які пришвидшують ферментативну реакцію (Са+2, Мg+2, К+, Na+, Cl-)
Ферментні реакції відбуваються зі швидкостями, більшими у 108 – 1020 разів, ніж без каталізатора. Таке зростання швидкості пов’язане зі зміною енергії активації біохімічних реакцій.
Суттєве зменшення енергії активації каталітичних реакцій пов’язане зі зміною механізму їх перебігу, який включає утворення однієї або кількох проміжних сполук.
За Фішером фермент і субстрат повинні відповідати, як ключ до замка.
За теорією Кошланда (1959 р.) субстрат з’єднуючись з ферментом викликає зміни в структурі ферменту. Аналогією в цьому випадку може служити рукавичка (фермент), яка при вдягненні її на руку, відповідним чином змінює свою форму.
За теорією Міхаеліса- Ментен, процес ферментного каталізу складається з ряду стадій:
1) утворення фермент-субстратного комплексу FS;
2) перетворення FS на FР
3) розпад проміжного комплексу FР з утворенням кінцевих продуктів реакції Р і вивільненням ферменту F
У загальному вигляді ферментна реакція відбувається за такою схемою де k1, k2, k3- константи швидкості відповідних реакцій.
| K1 k3 S + F « FS ® FP ® F + P k2 |
де Fі S - фермент і субстрат відповідно;
F S – фермент-субстратнийкомплекс;
F Р – фермент-продуктний комплекс
P – продукт реакції.
Визначення активності ферментів за швидкістю перебігу реакцій, що проводиться в клінічних лабораторіях має важливе значення для діагностики багатьох захворювань. Так, за зміною активності ферменту аспартатамінотрансферази (АсАТ) в крові можна діагностувати інфаркт міокарда в перші години захворювання з більшою точністю (96%), ніж за допомогою методу ЕКГ. Цей метод діагностики ґрунтується на тому, що при інфаркті міокарду спостерігається різке підвищення активності ферменту АсАТ. У багатьох випадках підвищення концентрації ферменту АсАТ у сироватці крові характерне ще до появи електрокардіографічних змін у міокарді.
Збільшення активності ферменту аланінамінотрансферази (АлАТ) є надійним діагностичним критерієм гострої стадії гепатиту, а підвищення активностіамілази в сечі - ознакою запалення підшлункової залози.
Каталітична активність більшості ферментів виявляється у великому інтервалі температур - від 10 до 56 °С. За вищих температур руйнується білкова основа ферменту, тобто відбувається процес денатурації білків, а за нижчих - перебіг ферментних процесів сповільнюється, що пов'язане зі зростанням в'язкості внутрішньо- та міжклітинних рідин.
Кінетичні методи дослідження є основними при кількісному вивченні механізмів різноманітних процесів не тільки в хімії, але в біології та медицині. Численні біохімічні реакції, що протікають у живому організмі, зумовлюють його життєдіяльність. Швидкість цих реакцій залежить від багатьох факторів, зокрема, від каталітичного впливу ферментів. Клітинний обмін в значній мірі також зумовлений каталітичною дією ферментів.
ІНГІБУВАННЯ КАТАЛІТИЧНОЇ ДІЇ ФЕРМЕНТІВ
Швидкість деяких хімічних реакцій, у тому числі й ферментних, можна сповільнити за допомогою певних речовин, які одержали назву інгібіторів. У випадку ферментних реакцій вони зменшують активність ферментів. Наприклад, каталітичну дію гемових білків гальмують такі інгібітори, як ціаніди або карбон (ІІ) оксид, ферменту АТФ-ази – станум органічні сполуки та деякі антибіотики, а карбоангідрази – аніони карбонових кислот.
Активність ферментів, крім інгібіторів, знижують і деякі денатуруючи чинники – температура, радіоактивне випромінювання, сильні кислоти або основи, які спричинюють необоротні зміни в активних центрах ферментів.
За характером зв’язування з ферментом інгібітори поділяють на оборотні та необоротні. За механізмом дії інгібітори поділяють на 5 груп, найважливіші – конкурентні і неконкурентні .
Неконкурентним інгібітором є ціанід йон СN -, який міцно зв’язується з йонами активного центру цитохром оксидази. У результаті блокування фермент стає неактивним, перенесення електронів у ланцюзі дихання припиняється, процес клітинного дихання порушується, виникає стан гіпоксії.
Фармокологічна дія антибіотиків групи сульфаніламідів ґрунтується на реакції гальмування дії ферментів бактерій. Інгібітори аденозинперетворюючих ферментів (АПФ) використовують для лікування артеріальної гіпертонії, застійної серцевої недостатності, важких станів після інфаркту міокарда, а також з метою профілактики деяких захворювань нирок. Такі препарати, як каптоприл, лізоиноприл, енаприл тощо, пригнічуючи дію АПФ, нормалізують артеріальний тиск.
ЗАСТОСУВАННЯ ФЕРМЕНТНИХ ПРЕПАРАТІВ У МЕДИЦИНІ
Фестал, дегістал, мезим, пепсин, панкреатин (при порушенні функції органів травлення ); трипсин, хімотрипсин, ліпаза (для руйнування білкових утворень, що нагромаджуються у місцях опіків або при гнійних інфекціях); плазмін (інфаркт міокарду, тромбози судин головного мозку); стрептокіназа, стрептаза (тромбози судин).
Рибонуклеаза і дезоксирибонуклеаза виявляють протизапальну дію, затримують розвиток вірусів і аденовірусів і тому їх використовують для лікування вірусних інфекцій. Для комплексного розкладання білків, вуглеводів та ліпідів застосовують препарати, до складу яких входить по декілька ферментів, наприклад: ензистал, лізим, солі зим, фестал тощо.
Розділ медицини, що займається застосуванням ферментів як лікарських препаратів, називають ензимотерапією.
У наш час виробництво ферментних препаратів – це важлива і необхідна галузь промисловості, наприклад, для виробництва харчових продуктів – кефіру, різних видів сиру, пивних дріжджів, йогуртів тощо. Ферментні реакції мають велике значення у виробництві антибіотиків, біохімічному аналізі, для визначення деяких мікроелементів і біоорганічних сполук. Створена спеціальна галузь біохімії, яка займається дослідженням ферментних реакцій.
ЛІТЕРАТУРА
1. Галяс В. Л., Колотницький А. Г. Фізична і колоїдна хімія.- Львів, 2003.- 453с.
2. Мороз А. С., Луцевич Д. Д., Яворська.Л. П. Медична хімія. - Вінниця: Нова Книга, 2006.-С. 366 - 486.
3. Мороз А. С., Ковальова А. Г. Фізична та колоїдна хімія: Навч. посібник.-Львів: Світ, 1994.- С. 3 – 29, 132 - 162.
4. Медична хімія: Підр. Для вузів/ В. О. Калібабчук, Л. І. Грищенко, В. І. Галинська та ін.; Під ред. В. О. Калібабчук. – К.: Інтермед, 2006 – С. 56 – 99.
5. Садовнича Л. П., Хухрянський В. Г., Циганенко А. Я. Біофізична хімія.- К.: Вища школа, 1986.-217с.
6. Стрельцов О. А., Мельничук Д. О., Снітинський В. В. Фізична і колоїдна хімія.-Львів: Ліга-Прес, 2003.- 443 с.
7. Щукин Е.Д., Перцов А. В., Алимина Е. А. Колоидная зимия. – М.: Высшая школа, 2004. – 446 с.
8. Уильямс В., Уильямс Х. Физическая химия для биологов. – М.: Мир, 1976. – 600 с.
Последнее изменение этой страницы: 2016-06-09
lectmania.ru. Все права принадлежат авторам данных материалов. В случае нарушения авторского права напишите нам сюда...