
Категории:
ДомЗдоровьеЗоологияИнформатикаИскусствоИскусствоКомпьютерыКулинарияМаркетингМатематикаМедицинаМенеджментОбразованиеПедагогикаПитомцыПрограммированиеПроизводствоПромышленностьПсихологияРазноеРелигияСоциологияСпортСтатистикаТранспортФизикаФилософияФинансыХимияХоббиЭкологияЭкономикаЭлектроника
ОСНОВНЫЕ ЗАКОНЫ И ПОНЯТИЯ ХИМИИ
Методы получения оксидов
1. Непосредственное взаимодействие элемента с кислородом
S+O2=SO2
2Ca+O2=2CaO
2. Окисление кислородом сложных веществ
2ZnS+3O2=2ZnO+2SO2
3. Разложение кислот, оснований и солей
H2SiO3  H2O+SiO2
H2O+SiO2
2Al(OH)3  3H2O+Al2O3
3H2O+Al2O3
CaCO3  CaO+CO2
CaO+CO2
Методы получения оснований
1. Щелочи получают взаимодействием щелочных и щелочно-земельных металлов с водой, при этом выделяется водород
2K+2H2O=2KOH+H2
2. Щелочи образуются при взаимодействии соответствующих основных оксидов с водой
Na2O+H2O=2NaOH
BaO+H2O=Ba(OH)2
3. Нерастворимые в воде основания получают обменной реакцией между солью и щелочью
AlCl3+3NaOH=Al(OH)3+3NaCl
Методы получения кислот
1. Бескислородные кислоты можно получать синтезом из водорода и соответствующего неметалла с последующим растворением образовавшегося газообразного водородного соединения в воде
H2+Cl2=2HCl
H2+S=H2S
2. Кислородсодержащие кислоты получают взаимодействием кислотных оксидов (ангидридов кислот) с водой
N2O5+H2O=2HNO3
SO3+H2O=H2SO4
3. Кислоты можно получать действием другой кислоты на соответствующую соль, при этом сильные кислоты вытесняют слабые из их солей
K2S+2HCl=2KCl+H2S
Методы получения солей
1. Реакция нейтрализации (взаимодействие кислоты с основанием)
Ca(OH)2+2HCl=CaCl2+2H2O
2. Взаимодействие металла с неметаллом
2Fe+3Cl2=2FeCl3
3. Взаимодействие металла с кислотой. Это взаимодействие идет по разному в зависимости от характера металла и характера кислоты.
Все металлы расположены в так называемом ряду напряжений, в который включен также и водород.
Ряд напряжений (сокращенный)
Zi K Ca Na Mg Al Zn Fe Pb HCu Ag Au
Металлы, стоящие в ряду напряжений до водорода, реагируют с кислотами с образованием соли и выделением водорода: Ca+2HCl® CaCl2 +H2 .
Металлы, стоящие после водорода, не вытесняют водород из кислот: Cu+HCl¹.
Однако при взаимодействии металлов, независимо от их положения в ряду напряжений, с концентрированной серной кислотой и азотной кислотой любой концентрации водород не выделяется:
4Zn+10HNO3=4Zn(NO3)2+NH4NO3+3H2O
4Zn+5H2SO4 (конц.)=4ZnSO4+H2S+4H2O,
но Zn+H2SO4 (разбавл.)=ZnSO4+H2.
4. Взаимодействие металла с солью. Реакция протекает в том случае, если реагирующий металл стоит в ряду напряжений левее металла, входящего в состав соли
Fe+CuSO4=FeSO4+Cu
5. Взаимодействие основного оксида с кислотным
CaO+SO3=CaSO4
6. Взаимодействие основного оксида с кислотой
CuO+2HCl=CuCl2+H2O
7. Взаимодействие кислотного оксида с основанием
CO2+2NaOH=Na2CO3+H2O
8. Взаимодействие соли с кислотой
Na2CO3+2HCl = 2NaCl+H2CO3
9. Взаимодействие соли со щелочью
CrCl3+3NaOH=Cr(OH)3¯+3NaCl
10. Взаимодействие между собой двух солей в растворе. Эта реакция происходит реально в том случае, если одна из образующих солей выпадает в осадок
AgNO3+NaCl=AgCl¯+NaNO3
11. Чтобы превратить среднюю соль в кислую, надо добавить соответствующей кислоты
CaCO3+H2CO = Ca(HCO3)2 ¥
Вновь превратить кислую соль в среднюю можно действием соответствующего основания
Ca(HCO3)2+Ca(OH)2=2CaCO3 + 2H2O
______________
Многие реакции между веществами происходят в водных растворах. Содержание вещества в растворе можно определить, зная его концентрацию. Одним из наиболее употребительных способов выражения концентрации является массовая доля растворенного вещества в растворе или, упрощенно, массовая доля.
Массовой долей растворенного вещества в растворе называется отношение массы растворенного вещества к массе раствора. (I)
Массовая доля обозначается буквой w и выражается в долях единицы или в процентах (по массе).
Правомерным является и другое определение массовой доли.
Массовая доля растворенного вещества в растворе показывает, какая масса растворенного вещества содержится в 100 массовых единицах раствора. (II)
Пусть, например, имеется раствор соляной кислоты с массовой долей HCl 5%; иначе можно записать: 5%-ный (по массе) раствор соляной кислоты. Это означает, что: а) отношение массы соляной кислоты и массы ее раствора равно  ; б) масса соляной кислоты составляет 5% от массы ее раствора; в) в 100 г (мг, кг, т) раствора содержится 5 г (мг, кг, т) собственно соляной кислоты.
; б) масса соляной кислоты составляет 5% от массы ее раствора; в) в 100 г (мг, кг, т) раствора содержится 5 г (мг, кг, т) собственно соляной кислоты.
ПРИМЕРЫ ТИПОВЫХ ЗАДАЧ И ИХ РЕШЕНИЕ.
Задача 1. Определить степени окисления атомов всех элементов в соединениях: Cr2O3, K2Cr2O7, Ca3(PO4)2, NH4NO3.
При определении степеней окисления атомов следует руководствоваться следующим правилом: алгебраическая сумма степеней окисления всех атомов в молекуле вещества равна нулю, а в ионе – заряду иона. Для успешного решения подобных задач надо хорошо выучить элементы, у которых степень окисления атомов постоянна.
Решение.
Молекула Cr2O3 состоит из 3 атомов кислорода (степень окисления равна –2) и 2 атомов хрома (степень окисления неизвестна, х). Составляем уравнение: 2х+3(-2)=0, отсюда х=+3, получаем 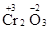 .
.
В молекуле K2Cr2O7 известны степени окисления калия (+1) и кислорода (-2). Составляем уравнение: 2(+1)+2х+7(-2)=0, получаем х=+6, 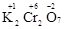 .
.
В соединении Ca3(PO4)2 неизвестна только степень окисления фосфора. Однако в данном случае составлять уравнение, подобное предыдущему, не стоит. Ca3(PO4)2 – фосфат кальция, соль фосфорной кислоты, H3PO4, а в кислотах и их солях степень окисления основного элемента (в данном случае фосфора) одинакова. Поэтому для определения степени окисления фосфора составим более простое уравнение для кислоты, от которой образована соль (Н3РО4): 3(+1)+х+4(-2)=0, отсюда х=+5, получаем  .
.
В молекуле NH4NO3 (нитрата аммония, соли азотной кислоты) неизвестна степень окисления двух разных атомов азота, х и у ( 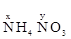 ). Степень окисления азота “у” определяем так же, как в предыдущем примере, т.е. по формуле азотной кислоты, HNO3: 1(+1)+у+3(-2)=0; у=5.
). Степень окисления азота “у” определяем так же, как в предыдущем примере, т.е. по формуле азотной кислоты, HNO3: 1(+1)+у+3(-2)=0; у=5.
Степень окисления азота «х» определяем, зная, что ион аммония (NH4+) имеет заряд 1+: х+4(+1)=+1, отсюда х=-3. Получаем  .
.
Задача 2. Чему равен объем (н.у) сероводорода массой 8,5 г? Сколько молей и молекул H2S содержится в этой массе?
Известно, что 1 моль любого вещества имеет массу, называемую молярной массой, и содержит число Авогадро (NА=6,02·1023) молекул. Известно также, что если вещество является газом или паром, то при нормальных условиях (н.у.) объем его 1 моль равен 22,4 л.
Решение.
В данном случае имеем соотношение (А):
(А) 1 моль H2S – 34 г HzS – 22,4 л (н.у.) – 6,02 w23 молекул H2S. ¥ Введем обозначения:  - массаH2S,
- массаH2S,
 - объем H2S,
- объем H2S,
 - число молекул H2S,
- число молекул H2S,
 - количество (число молей) H2S.
- количество (число молей) H2S.
Задачу можно решить двумя способами.
Й способ.
Сначала определим количество вещества:
 =
=  =
=  = 0,25 моль.
= 0,25 моль.
По количеству вещества определим остальные параметры:
 = 0,25 моль× 22,4л/моль = 5,6 л
= 0,25 моль× 22,4л/моль = 5,6 л
 =
=  × NA= 0,25 моль × 6,02 × 1023 мол-л/моль =
× NA= 0,25 моль × 6,02 × 1023 мол-л/моль =
= 1,50 × 1023 молекул.
2-й способ.
Количество вещества определим так же, как и в 1-м способе:
 =
=  =0,25 моль.
=0,25 моль.
Что же касается определения объема газа и числа молекул, то эти величины можно рассчитать непосредственно из соотношения (А). Из него следует, что в 34 г H2S содержится 6,02 × 1023 молекул H2S, а объем (н.у.) H2S массой 34 г составляет 22,4 л. Составим две пропорции:
34 г H2S – 6,02 × 1023 молекул H2S
8,5 г H2S – х молекул H2S,
отсюда x=1,5 ×1023 молекул
34 г H2S – 22,4 л H2S
8,5 г H2S – у л H2S,
отсюда у=5,6 л
В данной задаче 1-й способ является более удобным и легким, но если бы, например, в задаче требовалось определить только объем H2S (н.у.) массой 8,5 г, то более рационально было бы воспользоваться пропорцией
34 г H2S – 22,4 H2S
8,5 г H2S – у л H2S.
у=5,6 л
и определить искомую величину в одно действие.
Задача 3. Определить, сколько атомов кислорода содержится в
4,9 г серной кислоты.
Решение подобных задач основывается на законе постоянства состава.
Напишем формулу серной кислоты, H2SO4. В одной молекуле H2SO4 содержится два атома водорода, 1 атом серы и 4 атома кислорода. Если возьмем 1 моль H2SO4, т.е. 6,02 × 1023 молекул серной кислоты. То в нем будет содержаться:
2 × 6,02 × 1023 атомов водорода (т.е. 2 моль атомов Н),
1 × 6,02 × 1023 атомов серы (т.е. 1 моль атомов S),
4 × 6,02 × 1023 атомов кислорода (т.е. 4 моль атомов О).
Отсюда получаем, что в 1 моль любого вещества содержится столько же моль атомов каждого элемента, сколько атомов этих элементов входит в состав молекулы соединения. При этом соотношение между числом моль атомов в 1 моль вещества будет одинаковым для любого количества этого вещества. Так в данном примере это соотношение будет следующим:
1 моль H2SO4 –2 моль атомов Н: 1 моль атомов S: 4 моль атомов О.
А поскольку моль вещества (в данном случае H2SO4) и моль атомов каждого элемента (H, S, O) имеют определенную молярную массу, то получаем и соответствующее отношение масс:
98 г H2SO4 (1 моль × 98 г/моль) – 2 г Н (2 × 1 г/моль) :
32 г S (1 моль × 32 г/моль) : 64 г О (4 моль × 16 г/моль).
Решение.
1-й способ.
Определим, какое количество (n) H2SO4 содержится в 4,9 г H2SO4:
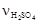 =
=  4,9 г моль/98 г =0,05 моль. Составим пропорцию
4,9 г моль/98 г =0,05 моль. Составим пропорцию
1 моль H2SO4- 4 моль ат. О
0,05 моль H2SO4 – х моль ат. О,
отсюда х = 0,2 атомов О.
Зная, что 1 моль любых частиц (молекул, атомов, ионов и др.) содержит число Авогадро (NA) этих частиц, определим, сколько атомов кислорода (NО) содержится в 0,2 моль атомов О:
NО= 0,2 моль· 6,02·1023 атомов/моль = 1,204 ·1023 атомов О.
Таким образом, в 4,9 г H2SO4 содержится 1,204· 1023 атомов кислорода.
Й способ.
Из формулы серной кислоты следует, что 1 моль H2SO4 имеет массу 98 г. Составим пропорцию
98 г H2SO4 – 4 моль ат. О
4,9 г H2SO4 – х моль ат. О,
отсюда х = 0,2 моль атомов О.
Тогда число атомов кислорода (NО) , будет равно N0 = 0,2 моль × 6,02 × 1023 атомов/моль= 1,204 · 1023 ат. О.
3-й способ.
В 1 моль серной кислоты содержится 4 моль атомов кислорода, моль серной кислоты имеет массу 98 г, а 4 моль атомов кислорода содержат 4 · 6,02 · 1023 атомов кислорода. Составляем пропорцию
98 г H2SO4 – 4 · 6,02 · 1023 ат. О
4,9 г H2SO4 – х ат. О,
отсюда х = 1,204 · 1023 атомов О.
Задача 4. Какой объем аммиака (при н.у.) будет содержать 6 моль атомов азота?
Согласно формуле аммиака (NH3 ) в 1 молекуле его содержится 3 атома азота, следовательно, 1 моль NH3 содержит 3 моль атомов азота. С другой стороны, 1 моль аммиака, как и всякого газа, при нормальных условиях (н.у.) занимает объем 22,4 л.
Решение.
1-й способ. Составим пропорцию:
1 моль NH3 – 3 моль ат. N
х моль NH3 – 6 моль ат. N,
отсюда х = 2 моль NH3 и объем аммиака (  ) при н.у. будет равен
) при н.у. будет равен
 =2 моль · 22,4 л/моль = 44,8 л.
=2 моль · 22,4 л/моль = 44,8 л.
Й способ.
Используя соотношение 22,2 л – 1 моль NH3 – 3 моль ат. N, составим пропорцию
22,4 л – 3 моль ат. N
х – 6 моль ат. N,
отсюда х = 44,8 л NH3.
Задача 5. В каком объеме сернистого газа (н.у.) содержится столько же молекул, сколько атомов натрия содержится в 7,1 г Na2SO4 ?
При решении подобных задач следует понимать, что в данном случае не требуется определять ни число атомов, ни число молекул. Из определения числа Авогадро следует, что какие бы частицы мы ни брали (молекулы, атомы, ионы, электроны и др.) число этих частиц будет одинаковым тогда, когда будут равны их количества. Поэтому фактически в таких задачах поставлен вопрос о сравнении числа молей (количества) различных частиц.
Решение.
Определим количество вещества  в 7,1 г Na2SO4.
в 7,1 г Na2SO4.
 =142 г/моль,
=142 г/моль,
отсюда
 = 7,1 г :142 г/моль = 0,05 моль атомов.
= 7,1 г :142 г/моль = 0,05 моль атомов.
В 1 моль Na2SO4 содержится 2 моль атомов Na. Определим, сколько моль атомов Na содержится в 0,05 моль Na2SO4:
1 моль Na2SO4 - 2 моль ат. Na
0,05 моль Na2SO4 - х моль ат. Na.,
отсюда х = 0,1 моль ат.Na.
По условию задачи число атомов Na должно быть равно числу молекул SO2 , а это будет в том случае, когда количества атомов Na и молекул SO2 будут одинаковыми. Отсюда следует, что количество сернистого газа равно 0,1 моль. Поскольку 1 моль любого газа при нормальных условиях занимает объем 22,4 л, получаем
 (н.у.) = 22,4 л/моль·0,01 моль = 2,24 л.
(н.у.) = 22,4 л/моль·0,01 моль = 2,24 л.
Таким образом, в 22,4 л SO2 (н.у.) будет содержаться столько же молекул SO2, сколько атомов Na содержится в 7,1 г Na2SO4 .
Задача 6. Определить массовую долю вещества в растворе, если в 40 г раствора содержится 8 г вещества.
Решение.
1-й способ.
В соответствии с определением (I), с. 18, - массовая доля w равна
w=mв-ва/mр-ра = 8 г /40 г = 0,2; или в процентах w = 20%.
2-й способ.
На основании определения (II) составляем пропорцию
8 г в-ва - 40 г р-ра
х г в-ва - 100 г р-ра,
отсюда х = 20 г.
Это означает, согласно определению (II) с. 18 , что w = 20%.
Задача 7. В 45 мл воды растворено 5 г сульфата натрия. Определить массовую долю Na2SO4 в растворе.
Решение.
Массовая доля Na2SO4 в растворе w равна
 =
=  /mр-ра.
/mр-ра.
Масса сульфата натрия составляет 5 г. Масса раствора складывается из массы растворенного вещества (Na2SO4) и массы растворителя (воды), которая неизвестна.
Зная, что плотность воды  равна 1 г/см3, а объем воды
равна 1 г/см3, а объем воды 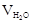 – 45 мл (см3), получаем
– 45 мл (см3), получаем
 =
= 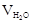 ·
·  = 45 мл · 1 г/мл = 45 г
= 45 мл · 1 г/мл = 45 г
Тогда масса раствора (m р-ра) будет
mр-ра=  +
+  = 5 г+45 г = 50 г
= 5 г+45 г = 50 г
и  = 5 г/ 50 г =0,1 или 10%.
= 5 г/ 50 г =0,1 или 10%.
Задача 8. Сколько граммов раствора серной кислоты с массовой долей H2SO4 20% надо взять для полной реакции с 20 мл 10 %-ного (по массе) раствора гидроксида натрия с плотностью раствора r = 1,109 г/мл?
При решении подобных задач следует четко понимать, что: 1) поскольку вещества вступают в реакцию, то необходимо составить уравнение реакции, по которому и будет производиться основной расчет; 2) в реакции, соответствующей составленному уравнению, участвуют чистые вещества, содержащиеся в растворах, из чего следует, что в расчетах по уравнению необходимо использовать массы растворенных веществ, а не массы растворов.
Решение.
Составим уравнение реакции
2 NaOH + H2SO4= Na2SO4+2 H2O.
Определим массу NaOH, содержащуюся в 20 мл 10%-ного по массе раствора с плотностью r=1,109 г/мл.
 =Vр-ра · r р-ра = 20 мл · 1,109 г/мл=22,18 г,
=Vр-ра · r р-ра = 20 мл · 1,109 г/мл=22,18 г,
а в растворе NaOH содержится 10% NaOH, отсюда
 = mр-ра · w = 22,18 г · 0,1 = 2,218 г.
= mр-ра · w = 22,18 г · 0,1 = 2,218 г.
По уравнению реакции определим массу серной кислоты, участвующей в реакции, зная, что
 = 40 г/моль, а
= 40 г/моль, а  =98 г/моль
=98 г/моль
и что, согласно уравнению, один моль серной кислоты реагирует с 2 моль гидроксида натрия. Составим пропорцию
98 г H2SO4 - 2 · 40 г NaOH
х г H2SO4 - 2,218 г NaOH,
отсюда х = 27,17 г.
Таким образом, в 20% - ном (по массе) растворе H2SO4 содержится 27,17 г H2SO4. Зная массовую долю серной кислоты в растворе (w H2SO4), определим массу раствора H2SO4
 =
=  /w= 27,17 г/ 0,2 =135,85 г.
/w= 27,17 г/ 0,2 =135,85 г.
Задача 9. Сколько литров углекислого газа (н.у.) образуется при взаимодействии 50 мл 8%-ного (по массе) раствора соляной кислоты (r р-ра HСl= 1,04 г/см3) с избытком раствора карбоната калия?
Решая подобные задачи, необходимо помнить, что объем 22,4 л для определения числа молей можно использовать только применительно к объему газа, так как 22,4 л/моль - это объем 1моль газа или пара (при н.у.). Применять же эту величину (22,4 л/моль) к расчетам, непосредственно связанным с объемом растворов, нельзя.
Решение.
Составим уравнение реакции
2HCl +К2CO3= 2КCl + CO2 +H2O
mр-ра HCl= V р-ра HCl · rр-ра=50 мл · 1,04 г/мл=52 г
mHСl = m р-ра HCl · w HСl = 52 г · 0,08 = 4,16 г.
Из уравнения реакции следует, что при взаимодействии 2 моль HCl с К2CO3 образуется 1 моль СО2 (н.у.) . Учитывая, что МHСl =36,5 г/моль, а 1 моль СО2 (н.у.) занимает объем 22,4 л, составим пропорцию
2 · 36,5 г HCl – 22,4 л СО2
4,16 г HCl – х л СО2,
отсюда х=1,26 л, т.е.  (н.у.) = 1,26 л.
(н.у.) = 1,26 л.
КОНТРОЛЬНЫЕ ВОПРОСЫ И ЗАДАЧИ
I. Теоретические вопросы.
1. Дайте определение понятий: атом, молекула, химический элемент.
2. Что называется простым веществом? Газ хлор – простое или сложное вещество?
3. Что называется атомной единицей массы? Как определить молекулярную массу вещества? Поясните на примере серной кислоты.
4. Дайте определение понятий: моль, число Авогадро. Что означает выражение «моль атомов»?
5. Сформулируйте закон постоянства состава вещества. Проиллюстрируйте его на примере.
6. Что называется молярной массой вещества? Как рассчитать число молей вещества, если известны масса вещества и его молярная масса?
7. Дайте определение закона Авогадро. Одинаковое ли количество вещества будет содержаться в равных объемах различных газов, взятых при одних и тех же условиях (давлении и температуре)?
8. Какой объем занимает 1 моль газа при нормальных условиях? Что такое нормальные условия? Как определить количество газа, если известен его объем при нормальных условиях?
9. Как определить количество вещества, если известно число молекул, содержащихся в нем?
10. Назовите классы неорганических соединений и приведите примеры.
11. Что такое оксиды? Какие типы оксидов существуют? Приведите примеры.
12. Что такое кислоты? Приведите примеры одно-, двух- и трехосновных кислот. Как определить заряд аниона – кислотного остатка?
13. Что такое основания? Чем определяется число гидроксильных групп в формуле основания? Какие основания растворяются в воде?
14. Какая реакция называется реакцией нейтрализации? Приведите примеры.
15. Что такое средние, кислые и основные соли? Приведите по одному примеру и назовите соли.
II. Назовите следующие соединения. К каким классам неорганических соединений они относятся?
| 16. | P2O 5 | Al(OH)3 | H3PO4 | CuCl2 | KHSO3 |
| 17. | CaO | Fe(OH)3 | HNO3 | Zn(NO3)2 | Pb(HSO4)2 |
| 18. | N2O5 | Cu(OH)2 | H2CO3 | NH4NO2 | Ca(H2PO4)2 |
| 19. | Al2O3 | Mg(OH)2 | HF | Cr2(SO4)3 | FeOH(NO3)2 |
| 20. | Na2O | Pb(OH)2 | HNO2 | K2SO3 | MgOHCl |
| 21. | MnO | Fe(OH)2 | H2SO3 | AgCl | Mg(HCO3)2 |
| 22. | ZnO | KOH | H2S | Na2SiO3 | (CuOH)2CO3 |
| 23. | Fe2O3 | Ba(OH)2 | H2SiO3 | ZnS | CaHPO4 |
III. Укажите степени окисления атомов всех элементов в формулах следующих соединений:
| 24. | Al2O3 | K2SO4 | Fe(NO3)3 | KMnO4 |
| 25. | N2O5 | Ca3(PO4)2 | NaHSO3 | K2MnO4 |
| 26. | MnO2 | Mg(NO3)2 | K2SO4 | CaHPO4 |
| 27. | Fe2O3 | H2CrO4 | FeOHCl2 | Na2SO3 |
| 28. | P2O 5 | Fe2(SO4)3 | K2Cr2O7 | MgOHCl |
| 29. | Mg3N2 | HClO4 | PbSO4 | NaHS |
| 30. | Al4C3 | NaNO2 | KClO3 | CaOHNO3 |
| 31. | Cr2S3 | NH4Cl | Na2B4O7 | KClO4 |
IV. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
32. Фосфор ® оксид фосфора (V) ® ортофосфорная кислота ® ортофосфат натрия ® ортофосфат кальция.
33. Натрий ® оксид натрия ® гидроксид натрия ® сульфат натрия ® сульфат бария.
34. Сера ® оксид серы (IV) ® сернистая кислота ® сульфит натрия ® гидросульфит натрия.
35. Железо ® хлорид железа (II) ® гидроксид железа (II) ® оксид железа (II) ®сульфат железа (II).
36. Углерод ® оксид углерода (IV) ® карбонат калия ® гидрокарбонат калия ® карбонат калия.
37. Железо ® хлорид железа (III) ® гидроксид железа (III) ® оксид железа (III) ® нитрат железа (III).
38. Цинк ® сульфат цинка ® гидроксид цинка ® нитрат цинка ® сульфид цинка.
39. Магний ® хлорид магния ® гидроксид магния ® сульфат магния ® фосфат магния.
V. Задачи.
40. Сколько молей атомов азота содержится в 0,4 г нитрата аммония (NH4NO3)? Какова масса этого количества азота?
41. Сколько граммов кислорода содержится в 2 моль азотной кислоты?
42. Определите количество фосфора, содержащегося в 8,75 г фосфата кальция?
43. В каком объеме хлора (нормальные условия) содержится столько же молекул, сколько их содержится в 49 г серной кислоты?
44. Сколько моль газов содержится в смеси, состоящей из 6,72 л азота и 5,6 л оксида углерода (IV)? Объемы газов измерены при нормальных условиях.
45. Масса 200 мл газа (нормальные условия) равна 0,232 г. Определите молярную массу этого газа.
46. Какой объем при нормальных условиях занимают 27 · 1021 молекул газа?
47. Где содержится больше атомов водорода: в двух литрах метана или в двух литрах водорода? Объемы газов измерены при нормальных условиях.
48. К 250 мл раствора соляной кислоты с массовой долей HCl 10% (плотность раствора 1,05 г/см3) добавили избыток раствора карбоната натрия. Какой объем оксида углерода (IV) (нормальные условия) может образоваться в результате реакции?
49. Сколько мл раствора соляной кислоты с массовой долей HCl 15% (плотность раствора 1,075 г/см3) потребуется для полного растворения 8,1 г алюминия?
50. Сколько литров водорода, измеренных при нормальных условиях, выделится при взаимодействии избытка цинка с 200 мл раствора соляной кислоты с массовой долей HCl 10% (плотность раствора 1,05 г/см3) ?
51. При взаимодействии 16 г раствора серной кислоты с избытком хлорида бария выделился осадок массой 5,7 г. Определите массовую долю серной кислоты в исходном растворе.
52. Сколько граммов раствора с массовой долей гидроксида калия 4% потребуется для полной нейтрализации 50 г раствора серной кислоты с массовой долей H2SO4 5%?
53. Для нейтрализации 200 г раствора азотной кислоты было израсходовано 150 мл 10%-ного по массе раствора гидроксида калия (плотность раствора 1,09 г/см3). Вычислите массовую долю азотной кислоты в растворе.
54. Сколько литров диоксида углерода (нормальные условия) нужно пропустить через 200 мл раствора гидроксида натрия с массовой долей NaOH 10% (плотность раствора 1,109 г/см3) для получения гидрокарбоната натрия?
55. Через 240 г раствора сульфата меди пропустили 16,8 л (н.у.) газа сероводорода для полного осаждения сульфида меди(II). Определите массовую долю CuSO4 в исходном растворе.
Домашние задания
| Вариант | |||||||||||||||
| Номера вопросов | |||||||||||||||
ОСНОВНЫЕ ЗАКОНЫ И ПОНЯТИЯ ХИМИИ
Все законы химии базируются на атомно-молекулярном учении, в связи с чем основополагающими понятиями в химии являются понятия атома и молекулы.
Атомом называется мельчайшая частица химического элемента, сохраняющая его химические свойства.
Атом каждого элемента состоит из ядра, масса которого складывается из определенного количества протонов и нейтронов, и вращающихся вокруг него электронов, число которых равно числу протонов, т.е. заряду ядра. Заряд ядра равен порядковому номеру элемента в Периодической системе Д.И. Менделеева и является величиной, определяющей химические свойства элемента. Например, порядковый номер цинка – 30, это означает, что ядро его атома содержит 30 протонов, заряд ядра равен +30, число электронов в атоме цинка – тридцать. Атомы, обладающие одинаковым зарядом ядра (и, следовательно, тождественными химическими свойствами), но разным числом нейтронов, называются изотопами.
Элементом называется вид атомов, характеризующихся определенной величиной положительного заряда ядра.
Все открытые на Земле элементы систематизированы в таблице Д.И. Менделеева. Они подразделяются на металлы и неметаллы. Каждый элемент имеет свое название и символ (например, Na – натрий, Р – фосфор).
Все вещества делятся на простые и сложные. Для большинства из них мельчайшей частицей является молекула, которая состоит из атомов, число которых и взаимное расположение в молекуле определяют свойства вещества.
Молекула – это наименьшая частица вещества, обладающая его химическими свойствами.
Молекулы могут состоять из атомов одного или нескольких элементов.
Простое вещество – это вещество, состоящее из атомов одного элемента.
Мельчайшей частицей, сохраняющей свойства простого вещества, может быть атом, а может быть молекула. Например, простое вещество железо состоит из атомов элемента железа, а простое вещество – из двухатомных молекул, образованных атомами одного элемента - кислорода.
Атомы одного и того же элемента могут образовывать несколько простых веществ, различных по своим свойствам. Это явление называется аллотропией, а вещества – аллотропическими модификациями. Аллотропические модификации отличаются друг от друга либо различным числом атомов в молекуле, например, кислород О2 и озон О3, либо разной кристаллической структурой, например, углерод, алмаз и карбин, химический знак которых – С.
Сложное вещество, или соединение, - это вещество, состоящее из атомов разных элементов.
Вид и число атомов в молекуле вещества изображаются химической формулой. Например, формула серной кислоты – H2SO4. Это означает, что молекула этого вещества состоит из одного атома серы, двух атомов водорода и четырех атомов кислорода. Соотношение между числом атомов разных элементов в молекуле определяется валентностью этих элементов.
Валентность элемента – это способность его атомов соединяться с другими атомами в определенных соотношениях.
Валентность – сложное понятие, его современное значение будет выяснено при изучении теории строения вещества.
Наряду с валентностью употребляется понятие степень окисления.
Степень окисления – это условный заряд атома данного элемента в соединении, вычисленный, исходя из предположения, что все атомы в молекуле ионизированы, т.е. имеют заряд.
Степень окисления может иметь положительное, отрицательное и нулевое значения, которые обычно ставятся над символом элемента сверху. Например, 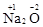 ,
, 
 . Степень окисления элементов в простых веществах равна нулю
. Степень окисления элементов в простых веществах равна нулю  Степень окисления некоторых элементов в их соединениях имеет постоянное значение. К таким элементам относятся щелочные металлы (степень окисления +1), металлы II А подгруппы Периодической системы (+2), а также серебро
Степень окисления некоторых элементов в их соединениях имеет постоянное значение. К таким элементам относятся щелочные металлы (степень окисления +1), металлы II А подгруппы Периодической системы (+2), а также серебро  , цинк
, цинк  , кадмий
, кадмий  , алюминий
, алюминий  . Водород проявляет степень окисления +1 во всех соединениях, кроме гидридов, в которых степень окисления водорода равна –1
. Водород проявляет степень окисления +1 во всех соединениях, кроме гидридов, в которых степень окисления водорода равна –1  . Степень окисления кислорода практически постоянна и составляет –2.
. Степень окисления кислорода практически постоянна и составляет –2.
Большинство элементов имеет переменную степень окисления, например, 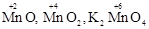 .
.
Массы атомов и молекул очень малы (10-25-10-20) и пользоваться ими при расчетах неудобно. Поэтому в химии введены относительные величины масс атомов и молекул, которые называются атомными или соответственно молекулярными массами. В качестве единицы измерения принята атомная единица массы (сокращенно а.е.м.), равная 1/12 массы атома изотопа углерода 12С.
Относительной атомной массой (или атомной массой) элемента называется масса его атома, выраженная в атомных единицах массы.
Атомные массы элементов определяются из таблицы Д.И. Менделеева, причем их значения принято округлять до целого числа. Исключение составляет масса хлора, равная 35,5.
Относительной молекулярной массой (или молекулярной массой) простого или сложного вещества называется масса его молекулы, выраженная в атомных единицах массы.
Атомные и молекулярные массы обычно приводятся без обозначения единицы измерения.
Важнейшей количественной единицей в химии является величина, называемая молем.
Моль – это количество вещества, содержащее столько молекул, атомов, ионов или других структурных единиц, сколько содержится атомов в 12 г изотопа углерода 12С.
В одном моле любого вещества содержится 6,02×1023 структурных единиц. Число 6,02×1023 называется числом Авогадро. ¥
Применяя понятие «моль», необходимо в каждом конкретном случае указывать, какие именно структурные единицы имеются в виду. Например, следует различать моль атомов Н, моль молекул Н2, моль ионов Н+. В моле атомов, молекул, ионов водорода содержится 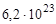 атомов, молекул, ионов водорода соответственно.
атомов, молекул, ионов водорода соответственно.
Масса 1 моль вещества называется молярной (или мольной) массой и выражается в г/моль.
Численно масса 1 моль любых структурных единиц равна массе этой структурной единицы, выраженной в а.е.м.
Одним из важнейших законов химии является закон постоянства состава.
Всякое химически чистое индивидуальное вещество, независимо от способа его получения, имеет постоянный качественный и количественный состав.
Исходя из представлений атомно-молекулярной теории это означает, что каждое химически чистое вещество состоит из одинаковых молекул, в состав которых входят атомы определенных элементов. При этом соотношение между числом атомов каждого элемента и, следовательно, соотношение между их массами определяются молекулярной формулой вещества и остаются постоянными независимо от количества вещества и способа его получения.
Вещества способны вступать между собой в химические реакции.
Процессы, при которых одни вещества превращаются в другие, отличающиеся от исходных своим составом и свойствами, называются химическими.
В основе химических процессов (реакций) лежит закон сохранения массы вещества.
Масса веществ, вступающих в химическую реакцию, равна массе веществ, образующихся в результате реакции.
Этот закон является частным случаем основополагающего закона природы – закона сохранения материи.
Закон сохранения массы вещества в химии выражается в составлении уравнения реакции, которое показывает, какие вещества и в каком количественном соотношении участвуют в данном процессе.
Химическое уравнение состоит из двух частей, соединенных знаком равенства. В левой части записываются формулы веществ, вступающих в реакцию, а в правой – формулы веществ, образующихся в результате реакции, согласно закону сохранения массы вещества. Число атомов каждого элемента в левой и правой частях уравнения должно быть одинаковым. Для этого в случае необходимости подбирают и расставляют перед формулами исходных и конечных веществ коэффициенты, которые называются стехиометрическими коэффициентами.
Так, уравнение взаимодействия гидроксида алюминия с серной кислотой

после подбора коэффициентов будет выглядеть следующим образом:
 (1)
(1)
Коэффициенты в обеих частях уравнения химической реакции можно увеличивать или уменьшать в одинаковое число раз. Так, уравнение (1) можно записать следующим образом:

Примем n равным: а)2; б)1/2. Тогда уравнение (1) будет иметь вид
а)
Последнее изменение этой страницы: 2016-07-22
lectmania.ru. Все права принадлежат авторам данных материалов. В случае нарушения авторского права напишите нам сюда...