
Категории:
ДомЗдоровьеЗоологияИнформатикаИскусствоИскусствоКомпьютерыКулинарияМаркетингМатематикаМедицинаМенеджментОбразованиеПедагогикаПитомцыПрограммированиеПроизводствоПромышленностьПсихологияРазноеРелигияСоциологияСпортСтатистикаТранспортФизикаФилософияФинансыХимияХоббиЭкологияЭкономикаЭлектроника
Степень окисления. Окислители и восстановители. Методы подбора коэффициентов. Виды окислительно-восстановительных реакций (ОВР). Уравнение Нернста. Направление протекания реакций ОВР.
Окислительно-восстановительными называются реакции, сопровождающиеся изменением степени окисления атомов, входящих в состав реагирующих веществ. Под степенью окисления (n) понимают тот условный заряд атома, который вычисляется, исходя из предположения, что молекула состоит только из ионов. Окисление-восстановление – это единый взаимосвязанный процесс. Окисление приводит к повышению степени окисления восстановителя, а восстановление к её понижению у окислителя.Повышение или понижение степени окисления атомов отражается в электронных уравнениях исходя из того, что окислитель принимает электроны, а восстановитель их отдает. О возможности того или иного вещества проявлять окислительные, восстановительные или двойственные (как окислительные, так и восстановительные) свойства можно судить по степени окисления атомов, несущих эти функции. Например:
N5+(HNO3) , S6+(H2SO4) – проявляют только окислительные свойства;
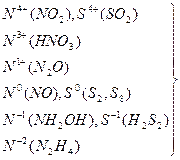 проявляют окислительные и восстановительные свойства
проявляют окислительные и восстановительные свойства
N3–(NH3) , S2–(H2S) – проявляют только восстановительные свойства;
При окислительно-восстановительных реакциях валентность атомов может и не меняться. Например, в окислительно-восстановительной реакции:
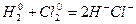
валентность атомов водорода и хлора до и после реакции равна единице. Изменилась их степень окисления. Валентность определяет число связей, образованных данным атомом, и поэтому знака не имеет. Степень же окисления имеет тот или иной знак.
Пример 1. Исходя из степени окисления (n) азота, серы и марганца в соединениях NН3, HNO2, НNО3, H2S, H2SO3, H2SO4, МnО2, КМnO4 определите, какие из них могут быть только восстановителями, только окислителями и какие проявляют как окислительные, так и восстановительные свойства.
Решение. Степень окисления n (N) в указанных соединениях соответственно равна:
– 3 (низшая), + 3 (промежуточная), + 5 (высшая);
n (S) соответственно равна: – 2 (низшая), + 4 (промежуточная), + 6 (высшая);
п (Mn) соответственно равна: +4 (промежуточная), +7 (высшая).
Отсюда:
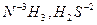
| – только восстановители; |
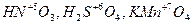
| – только окислители; |
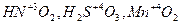
| – окислители и восстановители. |
Пример 2. Могут ли происходить окислительно-восстановительные реакции между веществами: a) H2S и HI; б) H2S и Н2SО3; в) H2SO3 и НСlO4?
Решение. а) Определяем степень окисления: n (S) в H2S = – 2; n (I) в HI = – 1. Так как и сера и йод имеют свою низшую степень окисления, то оба взятых вещества проявляют только восстановительные свойства и взаимодействовать друг с другом не могут; б) n (S) в H2S = – 2 (низшая); n (S) в H2SO3 = + 4 (промежуточная). Следовательно, взаимодействие этих веществ возможно, причем H2SO3 будет окислителем; в) n (S) в H2SO3 = + 4 (промежуточная); n (Сl) в НСlO4 = + 7 (высшая). Взятые вещества могут взаимодействовать. H2SO3 в этом случае будет проявлять уже восстановительные свойства.
Пример 3. Составьте уравнение окислительно-восстановительной реакции, идущей по схеме

Решение. Если в условии задачи даны как исходные вещества, так и продукты их взаимодействия, то написание уравнения реакции сводится, как правило, к нахождению и расстановке коэффициентов. Коэффициенты определяют методом электронного баланса при помощи электронных уравнений. Вычисляем, как изменяют свою степень окисления восстановитель и окислитель, и отражаем это в электронных уравнениях:
восстановитель 5|Р+3-2е=Р+5 | процесс окисления
окислитель 2|Мn+7+5е=Mn+2 | процесс окисления
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которое присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов является число 10. Разделив это число на 5, получаем коэффициент 2 для окислителя и продукта его восстановления, а при делении 10 на 2 получаем коэффициент 5 для восстановителя и продукта его окисления. Коэффициенты перед веществами, атомы которых не меняют свою степень окисления, находят подбором. Уравнение реакции будет иметь вид
2KMnO4 + 5H3PO3 + 3H2SO4 = 2MnSO4 + 5H3PO4 + K2SO4 + 3H2O
1. Исходя из степени окисления хлора в соединениях НСl, НClO3, НСlO4 определите, какое из них является только окислителем, только восстановителем и какое может проявлять как окислительные, так и восстановительные свойства. Почему? На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме
КВr + КBrО3 + Н2SO4 → Вr2 + К2SO4 + Н2О.
2. Реакции выражаются схемами:
Р + НIO3 + Н2О → H3РО4 + HI
H2S + Cl2 + Н2O → H2SO4 + HCl
Составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество является окислителем, какое – восстановителем; какое вещество окисляется, какое – восстанавливается.
3. Составьте электронные уравнения и укажите, какой процесс – окисление или восстановление – происходит при следующих превращениях:
As3– → As5+; N3+ → N3–; S2– → S0.
На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме
Na2SO3 + КМnO4 + Н2О → Na2SO4 + МnО2 + КОН
4. Исходя из степени окисления фосфора в соединениях PН3, Н3РO4, Н3РО3 определите, какое из них является только окислителем, только восстановителем и какое может проявлять как окислительные, так и восстановительные свойства. Почему? На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме PbS + HNO3 → S + Рb(NО3)2 + NO + H2O
5*. KMnO4 + Nа2SО3 + КОН → K2MnO4 + Na2SO4 + Н2О
Р + НNО3 + Н2О → Н3РО4 + NO
6. Составьте электронные уравнения и укажите, какой процесс – окисление или восстановление – происходит при следующих превращениях:
Мn6+ → Mn2+; Cl5+ → Cl–; N3– → N5+.
На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме Cu2O + HNO3 → Сu(NО3)2 + NО + Н2O.
7*. НNO3 + Са → NH4NО3 + Са(NО3)2 + Н2О
K2S + KMnO4 + H2SO4 → S + K2SO4 + MnSO4 + H2O
8. Исходя из степени окисления хрома, йода и серы в соединениях К2Сr2O7, KI и Н2SO4 определите, какое из них является только окислителем, только восстановителем и какое может проявлять как окислительные, так и восстановительные свойства. Почему? На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме
NaCrO2 + РbO2 + NaOH → Na2CrO4 + Na2PbO2 + Н2О
9*. H2S + Cl2 + H2O ? H2SO4 + HCl
K2Cr2O7 + H2S + H2SO4 → S + Сr2(SO4)3 + К2SО4 + Н2О
10*. KClO3 + Na2SO3 → KCl + Na2SO4
KMnO4 + HBr → Br2 + KBr + MnBr2 + H2O
11*. P + HClO3 + H2O → H3PO4 + HCl
H3AsO3 + KMnO4 + H2SO4 → H3AsO4 + MnSO4 + K2SO4 + H2O
12*. NaCrO2 + Br2 + NaOH → Na2CrO4 + NaBr + H2O
FeS + HNO3 → Fe(NO3)2 + S + NO + H2O
13*. HNO3 + Zn → N2O + Zn(NO3)2 + H2O
FeSO4 + KClO3 + H2SO4 → Fe2(SO4)3 + KCl + H2O
14*. K2Cr2O7 + HCl → Cl2 + CrCl3 + KCl + H2O
Au + HNO3 + HCl → AuCl3 + NO + H2O
15. Могут ли происходить окислительно-восстановительные реакции между веществами: а) NН3 и КМnO4; б) HNO3 и HI; в) HCl и H2Se? Почему? На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме
KMnO4 + KNO2 + H2SO4 → MnSO4 + KNO3 + K2SO4 + H2O
16*. HCl + CrO3 → Cl2 + CrCl3 + H2O
Cd + KMnO4 + H2SO4 → CdSO4 + K2SO4 + MnSO4 + H2O
17*. I2 + NaOH → NaOI + NaI
MnSO4 + PbO2 + HNO3 → HMnO4 + Pb(NO3)2 + PbSO4 + H2O
18*. H2SO3 + HClO3 → H2SO4 + HCl
FeSO4 + K2Cr2O7 + H2SO4 → Fe2(SO4)3 + Cr2(SO4)3 + K2SO4 + H2O
19*. I2 + Cl2 + H2O → HIO3 + HCl
FeCO3 + KMnO4 + H2SO4 → Fe2(SO4)3 + CO2 + MnSO4 + K2SO4 + H2O
20. Могут ли происходить окислительно-восстановительные реакции между веществами: а) PH3 и HBr б) K2Cr2O7 и H3PO3 в) HNO3 и H2S? На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме:
AsH3 + HNO3 → H3AsO4 + NO2 + H2O
ЭЛЕКТРОДНЫЕ ПОТЕНЦИАЛЫ И ЭЛЕКТРОДВИЖУЩИЕ СИЛЫ*
Электродные потенциалы. Двойной электрический слой. Стандартные электродные потенциалы. Ряд напряженности металлов. Два вывода , сделанные по ряду напряженности металлов.
При решении задач этого раздела см. табл.1.
Стандартным электродным потенциалом, металла называют его электродный потенциал, возникающий при погружении металла в раствор собственного иона с концентрацией или активностью, равной 1 г-ион/л, измеренный по сравнению со стандартным водородным электродом, потенциал которого при 25°С условно принимается равным нулю (Е0 = 0; ΔG0 = 0).
Располагая металлы в ряд по мере возрастания их стандартных электродных потенциалов (Е0), получаем так называемый “ряд напряжений”.
Положение того или иного металла в ряду напряжений характеризует его восстановительную способность,
Таблица 1 - Стандартные электродные потенциалы Е0 некоторых металлов (ряд напряжений)
| Электрод | Е0, В | Электрод | E0, В |
| Li+/Li Rb+/Rb K+/K Cs+/Cs Ba2+/Ba Ca2+/Ca Na+/Na Mg2+/Mg Al3+/Al Ti2+/Ti Zr4+/Zr Mn2+/Mn V2+/V Cr2+/Cr Zn2+/Zn Cr3+/Cr Fe2+/Fe | – 3,045 – 2,925 – 2,924 – 2,923 – 2,90 – 2,87 – 2,714 – 2,37 – 1,70 – 1,603 – 1,58 – 1,18 – 1,18 – 0,913 – 0,763 – 0,74 – 0,44 | Cd2+/Cd Co2+/Co Ni2+/Ni Sn2+/Sn Pb2+/Pb Fe3+/Fe 2H+/H2 Sb3+/Sb Bi3+/Bi Cu2+/Cu Cu+/Cu Hg22+/2Hg Ag+/Ag Hg2+/Hg Pt2+/Pt Au3+/Au Au+/Au | – 0,403 – 0,277 – 0,25 – 0,136 – 0,127 – 0,037 – 0,000 + 0,20 + 0,215 + 0,34 + 0,52 + 0,79 + 0,80 + 0,85 + 1,19 + 1,50 + 1,70 |
а также окислительные свойства его ионов в водных растворах при стандартных условиях. Чем меньше значение Е0, тем большими восстановительными способностями обладает данный металл в виде простого вещества и тем меньше окислительные способности проявляют его ионы. И наоборот. Электродные потенциалы измеряют в приборах, которые получили название гальванических элементов. Окислительно-восстановительная реакция, которая лежит в основе работы гальванического элемента, Протекает в направлении, в котором э. д. с. элемента имеет положительное значение. В этом случае
ΔG0 < 0, так как ΔG0= – nFE0.
Пример 1. Стандартный электродный потенциал никеля больше, чем у кобальта (табл.4). Изменится ли это соотношение, если измерить потенциал никеля в растворе его ионов с концентрацией 0,001 г-ион/л, а кобальта – 0,1 г-ион/л?
Решение. Электродный потенциал металла (Е) зависит от концентрации его ионов в растворе. Эта зависимость выражается уравнением Нернста:

где E0 – стандартный электродный потенциал; п – число электронов, принимающих участие в процессе; С – концентрация (при точных вычислениях – активность) гидратированных ионов металла в растворе, г-ион/л. Е0 для никеля и кобальта соответственно равны – 0,25 и – 0,277В. Определим электродные потенциалы этих металлов при данных в условии концентрациях:
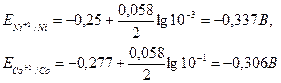
Таким образом, при изменившейся концентрации потенциал кобальта стал больше потенциала никеля.
Пример 2. Магниевую пластинку опустили в раствор его соли. При этом электродный потенциал магния оказался равен – 2,41 В. Вычислите концентрацию ионов магния в г-ион/л.
Решение. Подобные задачи также решаются на основании уравнения Нернста (см. пример 1):

Пример 3. Составьте схему гальванического элемента, в котором электродами являются магниевая и цинковая пластинки, опущенные в растворы их ионов с активной концентрацией 1 г-ион/л. Какой металл является анодом, какой катодом? Напишите уравнение окислительно-восстановительной реакции, протекающей в этом гальваническом элементе, и вычислите его э. д. с.
Решение. Схема данного гальванического элемента
(-) Мg|Mg+2||Zn+2|Zn (+)
Вертикальная черта обозначает поверхность раздела между металлом и раствором, а две черточки – границу раздела двух жидких фаз – пористую перегородку (или соединительную трубку, заполненную раствором электролита). Магний имеет меньший потенциал (– 2,37 В) и является анодом, на котором протекает окислительный процесс:
Mg-2e=Mg+2 (1)
Цинк, потенциал которого – 0,763 В, – катод, т.е. электрод, на котором протекает восстановительный процесс:
Zn+2+2e=Zn (2)
Уравнение окислительно-восстановительной реакции, которая лежит в основе работы данного гальванического элемента, можно получить, сложив электронные уравнения анодного (1) и катодного (2) процессов:
Mg + Zn+2 = Mg+2 + Zn
Для определения электродвижущей силы – э. д. с. гальванического элемента из потенциала катода следует вычесть потенциал анода. Так как концентрация ионов в растворе равна 1 г-ион/л, то э. д. с. элемента равна разности стандартных потенциалов двух его электродов:

21. В два сосуда с голубым раствором медного купороса поместили: в первый цинковую пластинку, а во второй серебряную. В каком сосуде цвет раствора постепенно пропадает? Почему? Составьте электронные и молекулярное уравнения соответствующей реакции.
22. Увеличится, уменьшится или останется без изменения масса цинковой пластинки при взаимодействии ее с растворами: a) CuSO4; б) MgSO4; в) Рb(NО3)2? Почему? Составьте электронные и молекулярные уравнения соответствующих реакций.
23. При какой концентрации ионов Zn2+ (в г-ион/л) потенциал цинкового электрода будет на 0,015 В меньше его стандартного электродного потенциала. Ответ: 0,30 г-ион/л.
24. Увеличится, уменьшится или останется без изменения масса кадмиевой пластинки при взаимодействии ее с растворами: a) AgNO3; б) ZnSO4; в) NiSO4? Почему? Составьте электронные и молекулярные уравнения соответствующих реакций.
25. Марганцевый электрод в растворе его соли имеет потенциал – 1,23 В. Вычислите концентрацию ионов Mn2+ в г-ион/л. Ответ: 1,89.102 г-ион/л.
26. Потенциал серебряного электрода в растворе AgNO3 составил 95% от величины его стандартного электродного потенциала. Чему равна концентрация ионов Ag+ в г-ион/л? Ответ: 0,20 г-ион/л.
27. Никелевый и кобальтовый электроды опущены соответственно в растворы Ni(NO3)2 и Со(NO3)2, В каком соотношении должна быть концентрация ионов этих металлов, чтобы потенциалы обоих электродов были одинаковыми? Ответ: 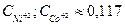
28. Составьте схемы двух гальванических элементов, в одном из которых медь была бы катодом, а в другом – анодом. Напишите для каждого из этих элементов электронные уравнения реакций, протекающих на катоде и на аноде.
29. При какой концентрации ионов Сu2+ в г-ион/л значение потенциала медного электрода становится равным стандартному потенциалу водородного элемента?
Ответ: 1,89 · 10–12 г-ион/л.
30. Какой гальванический элемент называется концентрационным? Составьте схему, напишите электронные уравнения электродных процессов и вычислите э. д. с. гальванического элемента, состоящего из серебряных электродов, опущенных первый в 0,01н., а второй, – в 0,1 н. растворы AgNO3. Ответ: 0,058 В.
31. При каком условии будет работать гальванический элемент, электроды которого сделаны из одного и того же металла? Составьте схему, напишите электронные уравнения электродных процессов и вычислите э.д.с. гальванического элемента, в котором один никелевый электрод находится в 0,001 М растворе, а другой такой же электрод – в 0,01 М растворе сульфата никеля. Ответ: 0,029 В.
32. Составьте схему, напишите электронные уравнения электродных процессов и вычислите э. д. с. гальванического элемента, состоящего из свинцовой и магниевой пластин, опущенных в растворы своих солей с концентрацией [Pb2+] = [Mg2+] = 0,01 г-ион/л. Изменится ли э. д. с. этого элемента, если концентрацию каждого из ионов увеличить в одинаковое число раз? Ответ: 2,244 В.
33. Составьте схемы двух гальванических элементов, в одном из которых никель является катодом, а в другом – анодом. Напишите для каждого из этих элементов электронные уравнения реакций, протекающих на катоде и на аноде.
34. Железная и серебряная пластины соединены внешним проводником и погружены в раствор серной кислоты. Составьте схему данного гальванического элемента и напишите электронные уравнения процессов, происходящих на аноде и на катоде.
35. Составьте схему, напишите электронные уравнения электродных процессов и вычислите э. д. с. гальванического элемента, состоящего из пластин кадмия и магния, опущенных в растворы своих солей с концентрацией [Mg2+] = [Cd2+] = 1 г-ион/л. Изменится ли величина э. д. с., если концентрацию каждого из ионов понизить до 0,01 г-ион/л? Ответ: 1,967 В.
36. Составьте схему гальванического элемента, состоящего из пластин цинка и железа, погруженных в растворы их солей. Напишите электронные уравнения процессов, протекающих на аноде и на катоде. Какой концентрации надо было бы взять ионы железа (в г-ион/л), чтобы э.д.с. элемента стала равной нулю, если [Zn2+] = 0,001 г-ион/л?
Ответ: 7,3 · 10–15 г-ион/л.
37. Составьте схему гальванического элемента, в основе которого лежит реакция, протекающая по уравнению
Ni + Pb(NO3)2 = Ni(NO3)2 + Pb
Напишите электронные уравнения анодного и катодного процессов. Вычислите э. д. с. этого элемента, если [Ni2+] = 0,01 г-ион/л, [Pb2+] = 0,0001 г-ион/л. Ответ: 0,066 В.
38. Какие химические процессы протекают на электродах при зарядке и разрядке свинцового аккумулятора?
39. Какие химические процессы протекают на электродах при зарядке и разрядке кадмий-никелевого аккумулятора?
40. Какие химические процессы протекают на электродах при зарядке и разрядке железо-никелевого аккумулятора?
ЭЛЕКТРОЛИЗ
Последнее изменение этой страницы: 2016-07-22
lectmania.ru. Все права принадлежат авторам данных материалов. В случае нарушения авторского права напишите нам сюда...