
Категории:
ДомЗдоровьеЗоологияИнформатикаИскусствоИскусствоКомпьютерыКулинарияМаркетингМатематикаМедицинаМенеджментОбразованиеПедагогикаПитомцыПрограммированиеПроизводствоПромышленностьПсихологияРазноеРелигияСоциологияСпортСтатистикаТранспортФизикаФилософияФинансыХимияХоббиЭкологияЭкономикаЭлектроника
Мультиплетность спектра и спин электрона
О. Штерн и В. Герлах, проводя прямые измерения магнитных моментов, обнаружили в 1922 г., что узкий пучок атомов водорода, заведомо находящихся в s-состоянии, в неоднородном магнитном поле расщепляется на два пучка. В этом состоянии момент импульса электрона равен нулю. Магнитный момент атома, связанный с орбитальным движением электрона, пропорционален механическому моменту, поэтому он равен нулю и магнитное поле не должно оказывать влияния на движение атомов водорода в основном состоянии, т. е. расщепления быть не должно. Однако в дальнейшем при применении спектральных приборов с большой разрешающей способностью было доказано, что спектральные линии атома водорода обнаруживают тонкую структуру (являются дублетами) даже в отсутствие магнитного поля.
Для объяснения тонкой структуры спектральных линий, а также ряда других трудностей в атомной физике американские физики Д. Уленбек (1900—1974) и С. Гаудсмит (1902—1979) предположили, что электрон обладает собственным неуничтожимым механическим моментом импульса, не связанным с движением электрона в пространстве, спином.
Спин электрона (и всех других микрочастиц) — квантовая величина, у нее нет классического аналога; это внутреннее неотъемлемое свойство электрона, подобное его заряду и массе.
Если электрону приписывается собственный механический момент импульса (спин) Ls, то ему соответствует собственный магнитный момент рms. Согласно общим выводам квантовой механики, спин квантуется по закону

где s — спиновое квантовое число.
По аналогии с орбитальным моментом импульса, проекция Lsz спина квантуется так, что вектор Ls может принимать 2s+1 ориентации. Так как в опытах Штерна и Герлаха наблюдались только две ориентации, то 2s+1=2, откуда s= ½ . Проекция спина на направление внешнего магнитного поля, являясь квантованной величиной, определяется выражением, аналогичным (223.6):

где тs — магнитное спиновое квантовое число; оно может иметь только два значения: ms = ± ½ .
Таким образом, опытные данные привели к необходимости характеризовать электроны (и микрочастицы вообще) добавочной внутренней степенью свободы. Поэтому для полного описания состояния электрона в атоме необходимо наряду с главным, орбитальным и магнитным квантовыми числами задавать еще магнитное спиновое квантовое число.
32. Результирующий механический момент многоэлектронного атома
Каждый электрон в атоме обладает орбитальным моментом импульса Ml и собственным моментом Ms. Механические моменты связаны с соответствующими магнитными моментами, вследствие чего между всеми Ml и Ms имеется взаимодействие.
Моменты Ml и Ms складываются в результирующий момент атома Ml. При этом возможны два случая.
1.Моменты Ml взаимодействуют между собой сильнее, чем с Ms, которые в свою очередь сильнее связаны друг с другом, чем с Мг. Вследствие этого все М( складываются в результирующую ML, a Ms складываются в MS, а затем уже ML и MS дают результирующую MJ. Такой вид связи встречается чаще всего и называется связью Рессель — Саундерса.
2.Каждая пара Мl и Ms взаимодействует между собой сильнее, чем с другими Mi и Ms, вследствие чего образуются результирующие Ml для каждого электрона в отдельности, которые затем уже объединяются в Ml атома. Такой вид связи, называемый (j,j)-связью, наблюдается у тяжелых атомов.
33.Магнитные момент атомов
Рассматривая действие магнитного поля на проводники с током и на движущиеся заряды, мы не интересовались процессами, происходящими в веществе. Свойства среды учитывались формально с помощью магнитной проницаемости m. Опыт показывает, что все вещества, помещенные в магнитное поле, намагничиваются. Рассмотрим причину этого явления с точки зрения строения атомов и молекул, положив в основу гипотезу Ампера, согласно которой в любом теле существуют микроскопические токи, обусловленные движением электронов в атомах и молекулах.
Для качественного объяснения магнитных явлений с достаточным приближением можно считать, что электрон движется в атоме по круговым орбитам. Электрон, движущийся по одной из таких орбит, эквивалентен круговому току, поэтому он обладаеторбитальным магнитным моментом pm=ISn, модуль которого
 (131.1)
(131.1)
где I=en — сила тока, n — частота вращения электрона по орбите, S — площадь орбиты. Если электрон движется по часовой стрелке (рис. 187), то ток направлен против часовой стрелки и вектор рm направлен перпендикулярно плоскости орбиты электрона, как указано на рисунке.
С другой стороны, движущийся по орбите электрон обладает механическим моментом импульса Le, модуль которого,
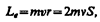 (131.2)
(131.2)
где v = 2pn, pr2 = S. Вектор Le называется орбитальным механическим моментом электрона.
Из рис. 187 следует, что направления рm и Le, противоположны, поэтому, учитывая выражения (131.1) и (131.2), получим
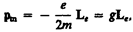 (131.3)
(131.3)
где величина
 (131.4)
(131.4)
называется гиромагнитным отношением орбитальных моментов.Формула (131.4) выведена для круговой орбиты, но она справедлива и для эллиптических орбит.
Физиками, было доказано, что кроме орбитальных моментов (см. (131.1) и (131.2)) электрон обладает собственным механическим моментом импульса Les, называемым спином. Спину электрона Les, соответствует собственный (сотовый) магнитный момент рms, пропорциональный Les и направленный в противоположную сторону:
 (131.5)
(131.5)
Величина gs называетсягиромагнитным отношением спиновых моментов.
Проекция собственного магнитного момента на направление вектора В может принимать только одно из следующих двух значений:

где ħ=h/(2p) (h—постоянная Планка), mb—магнетон Бора, являющийся единицей магнитного момента электрона.
В общем случае магнитный момент электрона складывается из орбитального и спинового магнитных моментов. Магнитный момент атома, следовательно, складывается из магнитных моментов входящих в его состав электронов и магнитного момента ядра (обусловлен магнитными моментами входящих в ядро протонов и нейтронов). Однако магнитные моменты ядер в тысячи раз меньше магнитных моментов электронов.
34.Эффе́кт Зе́емана — расщепление линий атомных спектров в магнитном поле.
Обнаружен в 1896 г. Зееманом для эмиссионных линий натрия.
Эффект обусловлен тем, что в присутствии магнитного поля квантовая частица, обладающая спиновым магнитным моментом, приобретает дополнительную энергию 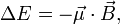 пропорциональную его магнитному моменту
пропорциональную его магнитному моменту 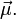 Приобретённая энергия приводит к снятию вырождения атомных состояний по магнитному квантовому числу
Приобретённая энергия приводит к снятию вырождения атомных состояний по магнитному квантовому числу 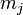 и расщеплению атомных линий.
и расщеплению атомных линий.
В классическом представлении
Атом, можно рассматривать как классический гармонический осциллятор, и его уравнение движения в присутствии магнитного поля 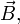 направленного вдоль оси Z, можно рассматривать в виде:
направленного вдоль оси Z, можно рассматривать в виде:

где 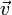 — скорость вращения электрона вокруг ядра,
— скорость вращения электрона вокруг ядра,  — масса электрона,
— масса электрона, 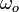 — резонансная частота электронного дипольного перехода. Введём величину, называемую ларморовской частотой
— резонансная частота электронного дипольного перехода. Введём величину, называемую ларморовской частотой 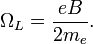
Резонансная частота дипольного момента в присутствии магнитного поля расщепляется на три частоты  Таким образом, в магнитном поле электрон вместо простого вращения вокруг ядра атома начинает совершать сложное движение относительно выделенного магнитным полем. Электронное облако атома прецессирует вокруг этой оси с частотой Лармора
Таким образом, в магнитном поле электрон вместо простого вращения вокруг ядра атома начинает совершать сложное движение относительно выделенного магнитным полем. Электронное облако атома прецессирует вокруг этой оси с частотой Лармора 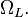
Такая простая модель объясняет наблюдаемое в экспериментах изменение поляризации флуоресценции атомарных паров в зависимости от направления наблюдения
35. Электронный Парамагнитный Резонанс
Суть метода заключается в резонансном поглощении электромагнитного излучения неспаренными электронами. Электрон имеет спин 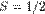 и ассоциированный с ним магнитный момент.
и ассоциированный с ним магнитный момент.
Если поместить свободный радикал с результирующим моментом количества движения J в магнитном поле с напряжённостью B0, то для J, отличного от нуля, в магнитном поле снимается вырождение, и в результате взаимодействия с магнитным полем возникает 2J+1 уровней, положение которых описывается выражением: W = gβB0M. Если к парамагнитному центру приложить электромагнитное поле с частотой ν,поляризованное в плоскости, перпендикулярной вектору магнитного поля B0, то оно будет вызывать магнитные дипольные переходы, подчиняющиеся правилу отбора ΔМ = 1. При совпадении энергии электронного перехода с энергией фотона электромагнитной волны будет происходить резонансное поглощение СВЧ излучения. Таким образом, условие резонанса определяются фундаментальным соотношением магнитного резонанса hν = gβB0.
36. Принцип Паули. Распределение электронов в атоме по состояниям
Два одинаковых фермиона, входящих в одну систему, не могут находиться в одинаковых состояниях, так как для фермионов волновая функция должна быть антисимметричной. В. Паули сформулировал принцип, согласно которому системы фермионов встречаются в природе только в состояниях, описываемых антисимметричными волновыми функциями. В системе одинаковых фермионов любые два из них не могут одновременно находиться в одном и том же состоянии. Отметим, что число однотипных бозонов, находящихся в одном и том же состоянии, не лимитируется.
Состояние электрона в атоме однозначно определяется набором четырех квантовых чисел: 
Распределение электронов в атоме подчиняется принципу Паули, который может быть использован в его простейшей формулировке: в одном и том же атоме не может быть более одного электрона с одинаковым набором четырех квантовых чисел п, l, ml и тs т. е.
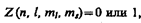
где Z(п, l, ml, тs) — число электронов, находящихся в квантовом состоянии, описываемом набором четырех квантовых чисел: п, l, ml, тs.
Максимальное число электронов, находящихся в состояниях, определяемых данным главным квантовым числом, равно
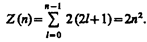
37. Периодическая система элементов Менделеева
Принцип Паули, лежащий в основе систематики заполнения электронных состояний в атомах, позволяет объяснитьПериодическую систему элементов Д. И. Менделеева (1869).Менделеев ввел понятие порядкового номера Z химического элемента, равного числу протонов в ядре и числу электронов в электронной оболочке атома. Расположив химические элементы по мере возрастания порядковых номеров, он получил периодичность в изменении химических свойств элементов. Таким образом, не только правильно расположил известные элементы, но и предсказал существование новых, еще не открытых элементов и их основные свойства. Кроме того, Д. И. Менделееву удалось уточнить атомные веса некоторых элементов. Например, атомные веса Be и U, вычисленные на основе таблицы Менделеева, оказались правильными, а полученные ранее экспериментально — ошибочными.
Так как химические и некоторые физические свойства элементов объясняются внешними (валентными) электронами в атомах, то периодичность свойств химических элементов должна быть связана с определенной периодичностью в расположении электронов в атомах. Поэтому для объяснения таблицы будем считать, что каждый последующий элемент образован из предыдущего прибавлением к ядру одного протона и соответственно прибавлением одного электрона в электронной оболочке атома. Взаимодействием электронов пренебрегаем, внося, где это необходимо, соответствующие поправки. Единственный электрон атома водорода находится в состоянии 1s, характеризуемом квантовыми числами п=1 , l=0, ml=0 и ms=± ½; Оба электрона атома Не находятся в состоянии 1s, но с антипараллельной ориентацией спина. Электронная конфигурация для атома Не записывается как 1s2(два 1s-электрона). На атоме Не заканчивается заполнение K-оболочки, что соответствует завершению I периода .
Третий электрон атома Li (Z=3), согласно принципу Паули, уже не может разместиться в целиком заполненной K-оболочке и занимает наинизшее энергетическое состояние с n=2 (L-оболочка), т.е. 2s-состояние. И так далее…
38. . Рентгеновские спектры
Распространенным источником рентгеновского излучения является рентгеновская трубка, в которой сильно ускоренные электрическим полем электроны бомбардируют анод, испытывая на нем резкое торможение. При этом возникает рентгеновское излучение, представляющее собой электромагнитные волны с длиной волны примерно 10–12—10–8 м.
Спектр представляет собой наложение сплошного спектра, ограниченного со стороны коротких длин волн некоторой границей lmin, называемой границей сплошного спектра, и линейчатого спектра — совокупности отдельных линий, появляющихся на фоне сплошного спектра.
Характер сплошного спектра совершенно не зависит от материала анода, а определяется только энергией бомбардирующих анод электронов. Детальное исследование свойств этого излучения показало, что оно испускается бомбардирующими анод электронами в результате их торможения при взаимодействии с атомами мишени.
Чем больше кинетическая энергия электронов, вызывающих тормозное рентгеновское излучение, тем меньше lmin. Это обстоятельство, а также наличие самой границы объясняются квантовой теорией.
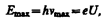
где U—разность потенциалов, за счет которой электрону сообщается энергия Еmax, nmax — частота, соответствующая границе сплошного спектра. Отсюда граничная длина волны
 (229.1)
(229.1)
что полностью соответствует экспериментальным данным. При достаточно большой энергии бомбардирующих анод электронов на фоне сплошного спектра появляются отдельные резкие линии — линейчатый спектр, определяемый материалом анода и называемый характеристическим рентгеновским спектром (излучением).
Исследуя рентгеновские спектры элементов, английский физик Г. Мозли (1887—1915) установил в 1913 г. соотношение, называемое законом Мозли:
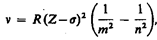 (229.2)
(229.2)
где n — частота, соответствующая данной линии характеристического рентгеновского излучения, R — постоянная Ридберга, s — постоянная экранирования, т = 1, 2, 3, .
Энергия молекулы.
Энергия молекулы складывается из энергий ее поступательного движения, вращения и колебаний атомов. При не слишком высоких температурах эти движения можно считать независимыми друг от друга.
Энергия молекулы, описываемой линейной комбинацией структур, всегда ниже, чем энергия любой из этих структур. Это следует из вариационного принципа квантовой механики ( см. гл.
Энергия молекул обусловлена их движением, а также движением входящих в их состав атомов.
Энергия молекул обусловлена их движением, а также движением входящих в их состав атомов.
Энергия молекулы определяется: 1) состоянием электронов, 2) колебаниями ядер относительно друг друга, 3) вращением молекулы как целого. Возбуждение различных видов движения молекулы требует разной по величине энергии. Наименьшее количество энергии требуется для возбуждения вращения молекулы. Необходимая для этого энергия изменяется от нескольких единиц до нескольких сотен обратных сантиметров.
Энергию молекулы находят как сумму энергий заполненных электронами МО; взаимодействием электронов друг с другом в первом приближении можно пренебречь. Переход электрона с атомной орбитали на молекулярную связывающую орбиталь сопровождается уменьшением его энергии - такая орбиталь стабилизирует систему. Наоборот, разрыхляющей орбитали соответствует более высокая энергия - электрону выгоднее находиться в атоме, чем в молекуле.
Энергию молекулы определяют как взятую с обратным знаком энергию, которая необходима для того, чтобы молекула в газообразном состоянии диссоциировала на изолированные газообразные атомы. Поэтому энергия стабильной молекулы всегда является отрицательной величиной. На рис. 1.1, 1.2 и 1.3 нули, от которых отсчитывают энергии, должны лежать на некотором расстоянии над каждой из этих кривых. Слово стабильный использовано здесь и в остальной части книги для обозначения низкой энергии, но отнюдь не включает представления о малой реакционной способности.
40 Молекулярные спектры, , принадлежащие свободным или слабо связанным между собой молекулам. М. с. имеют сложную структуру. Типичные М. с. — полосатые, они наблюдаются в испускании и поглощении и в комбинационном рассеянии в виде совокупности более или менее узких полос в ультрафиолетовой, видимой и близкой инфракрасной областях, распадающихся при достаточной разрешающей силе применяемых спектральных приборов на совокупность тесно расположенных линий.Конкретная структура М. с. различна для различных молекул и, вообще говоря, усложняется с увеличением числа атомов в молекуле. Для весьма сложных молекул видимые и ультрафиолетовые спектры состоят из немногих широких сплошных полос; спектры таких молекул сходны между собой.
М. с. возникают при квантовых переходах между уровнями энергии E‘ и E‘’ молекул согласно соотношению
hn = E‘ — E‘’, (1) где hn — энергия испускаемого поглощаемого фотона частоты n (h — Планка постоянная). При комбинационном рассеянии hn равно разности энергий падающего и рассеянного фотонов. М. с. гораздо сложнее линейчатых атомных спектров, что определяется большей сложностью внутренних движений в молекуле, чем в атомах. Наряду с движением электронов относительно двух или более ядер в молекулах происходят колебательное движение ядер (вместе с окружающими их внутренними электронами) около положений равновесия и вращательное движение молекулы как целого. Этим трём видам движений — электронному, колебательному и вращательному — соответствуют три типа уровней энергии и три типа спектров.
41)Комбинационное рассеивание света. Согласно квантовой теории, процесс К. р. с. состоит из двух связанных между собой актов — поглощения первичного фотона с энергией hν(h —Планка постоянная) и испускания фотона с энергией hν' (где ν' = ν ± νi), происходящих в результате взаимодействия электронов молекулы с полем падающей световой волны. Молекула, находящаяся в невозбуждённом состоянии, под действием кванта с энергией hν через промежуточное электронное состояние, испуская квант h(ν — νi), переходит в состояние с колебательной энергией hνi. Этот процесс приводит к появлению в рассеянном свете стоксовой линии с частотой ν — νi(). Если фотон поглощается системой, в которой уже возбуждены колебания, то после рассеяния она может перейти в нулевое состояние; при этом энергия рассеянного фотона превышает энергию поглощённого. Этот процесс приводит к появлению антистоксовой линии с частотой ν + νi
42) Вы́нужденное излуче́ние, индуци́рованное излучение — генерация новогофотона при переходе квантовой системы (атома, молекулы, ядра и т. д.) из возбуждённого в стабильное состояние (меньший энергетический уровень) под воздействием индуцирующего фотона, энергия которого была равна разности энергий уровней. Созданный фотон имеет те же энергию, импульс, фазу и поляризацию, что и индуцирующий фотон (который при этом не поглощается). Оба фотона являются когерентными
Большой вклад в разработку вопроса о вынужденном излучении (испускании) внесА. Эйнштейн. Гипотеза Эйнштейна состоит в том, что под действием электромагнитного поля частоты ω молекула (атом) может:
§ перейти с более низкого энергетического уровня  на более высокий
на более высокий 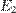 споглощением фотона энергией
споглощением фотона энергией  (см. рис. 1a);
(см. рис. 1a);
§ перейти с более высокого энергетического уровня 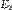 на более низкий
на более низкий 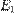 сиспусканием фотона энергией
сиспусканием фотона энергией  (см. рис. 1б);
(см. рис. 1б);
§ кроме того, как и в отсутствие возбуждающего поля, остаётся возможным самопроизвольный переход молекулы (атома) с верхнего на нижний уровень с испусканием фотона энергией 
Ла́зер (англ. laser, акроним от англ. light amplification by stimulated emission of radiation — усиление света посредством вынужденного излучения), опти́ческий ква́нтовый генера́тор — устройство, преобразующее энергию накачки (световую, электрическую, тепловую,химическую и др.) в энергию когерентного, монохроматического, поляризованного и узконаправленного потока излучения.
43) Кристаллическая решетка индексы Миллера.
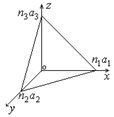 Для обозначения плоскостей и направлений кристалла используются так называемые кристаллографические индексы Миллера. Для их получения проведем оси координат X,Y,Z вдоль базисных векторов
Для обозначения плоскостей и направлений кристалла используются так называемые кристаллографические индексы Миллера. Для их получения проведем оси координат X,Y,Z вдоль базисных векторов  . Пусть некоторая плоскость пересекает такую координатную систему в точках с координатами:
. Пусть некоторая плоскость пересекает такую координатную систему в точках с координатами: 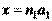 ;
; 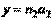 ;
; 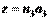 .
. 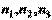 - целые или дробные числа, выражают наклон плоскостей по отношению к осям координатной системы. Теперь составим отношение обратных чисел
- целые или дробные числа, выражают наклон плоскостей по отношению к осям координатной системы. Теперь составим отношение обратных чисел  и приведем это отношение к отношению наименьших целых чисел:
и приведем это отношение к отношению наименьших целых чисел: 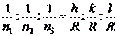 ; R - наименьшее кратное, а h, k, l и есть индексы Миллера для указанной плоскости. При обозначении плоскостей индексы Миллера заключаются в круглые скобки, без каких либо знаков между ними.
; R - наименьшее кратное, а h, k, l и есть индексы Миллера для указанной плоскости. При обозначении плоскостей индексы Миллера заключаются в круглые скобки, без каких либо знаков между ними.
Предположим  ;
; 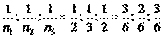 ;
; 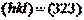 .
.
44)теплоемкость кристаллов в теории Энштейна.
Квантовая теория теплоёмкостей Эйнштейна − была создана Эйнштейном в 1907 году, при попытке объяснить экспериментально наблюдаемую зависимость теплоёмкости от температуры.
При разработке теории Эйнштейн опирался на следующие предположения:
§ Атомы в кристаллической решетке ведут себя как гармонические осцилляторы, не взаимодействующие друг с другом.
§ Частота колебаний всех осцилляторов одинакова.
§ Число осцилляторов в 1 моле вещества равно 3Na.
§ Энергия их квантована: 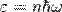 ,
, 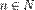
§ Число осцилляторов с различной энергией определяется распределением Больцмана: 
Внутренняя энергия 1 моля вещества:
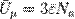 .
.  находится из соотношения для среднего значения:
находится из соотношения для среднего значения:
 и составляет:
и составляет: 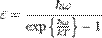 ,отсюда:
,отсюда: 
Определяя теплоёмкость как производную внутренней энергии по температуре, получаем окончательную формулу для теплоёмкости:
 .
.
45) Теория Дебая.В термодинамике и физике твёрдого тела модель Дебая — метод, развитый Дебаем в 1912 г. для оценки фотонного вклада в теплоёмкость твёрдых тел.
При тепловом равновесии энергия E набора осцилляторов с различными частотами 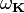 равна сумме их энергий:
равна сумме их энергий: 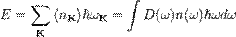 где
где 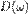 — число мод нормальных колебаний на единицу длины интервала частот,
— число мод нормальных колебаний на единицу длины интервала частот, 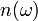 — количество осцилляторов в твёрдом теле, колеблющихся с частотой ω.
— количество осцилляторов в твёрдом теле, колеблющихся с частотой ω.
Функция плотности 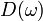 в трёхмерном случае имеет вид:
в трёхмерном случае имеет вид: 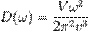
где V — объём твёрдого тела, 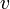 — скорость звука в нём.
— скорость звука в нём.
Значение квантовых чисел вычисляются по формуле Планка: 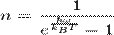
Тогда энергия запишется: 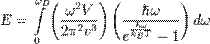
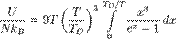
где 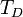 — температура Дебая,
— температура Дебая, 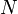 — число атомов в твёрдом теле,
— число атомов в твёрдом теле,  — постоянная Больцмана.
— постоянная Больцмана.
Дифференцируя внут. энергию по тем-ре получим: 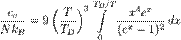
46. Фононы.
Фононы обладают энергиейЕ=  . Фонон есть квант энергии звуковой волны (так как упругие волны — волны звуковые). Фононы являются квазичастицами — элементарными возбуждениями, ведущими себя подобно микрочастицам.
. Фонон есть квант энергии звуковой волны (так как упругие волны — волны звуковые). Фононы являются квазичастицами — элементарными возбуждениями, ведущими себя подобно микрочастицам.
Квазичастицы, в частности фононы, сильно отличаются от обычных частиц (например, электронов, протонов, фотонов), так как они связаны с коллективным движением многих частиц системы. Квазичастицы не могут возникать в вакууме, они существуют только в кристалле. Импульс фонона обладает своеобразным свойством: при столкновении фононов в кристалле их импульс может дискретными порциями передаваться кристаллической решетке — он при этом не сохраняется. Поэтому в случае фононов говорят о квазиимпульсе.
Энергия кристаллической решетки рассматривается как энергия фононного газа:
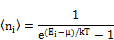
Фононы могут испускаться и поглощаться, но их число не сохраняется постоянным; поэтому в формуле распределения Бозе-Эйнштейна для фононов необходимо m положить равным нулю.
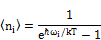
 – среднее знач.плотности фонона.
– среднее знач.плотности фонона.
47)Эффект Мёссбауэра или ядерный гамма-резонанс. эффект Мёссбауэра — это резонансное испускание и поглощение гамма-лучей без отдачи. Имеет существенно квантовую природу и наблюдается при изучении кристаллических, аморфных и порошковых образцов, содержащих один из 87изотопов 46 элементов.
Природа эффекта
При испускании или поглощении гамма-кванта, согласно закону сохранения импульса, свободное ядро массы M получает импульс отдачи p = E0/c и соответствующую этому импульсу энергию отдачи R = p2/(2M). На эту же величину оказывается меньше по сравнению с разностью энергий между ядерными уровнями E0 энергия испущенного гамма-кванта, а резонансное поглощение наблюдается для фотонов с энергией, равной E0 + R. В итоге, для одинаковых ядер линии испускания и поглощения разнесены на величину 2R и условие резонанса может быть выполнено только в случае совмещения этих линий, либо их частичного перекрытия. В газах энергию отдачи получает одно излучающее ядро массы M, тогда как в твёрдых телах помимо процессов, когда за счёт энергии отдачи возбуждаются фононы, при определённых условиях смещение только одного атома или небольшой группы атомов становится невозможным, и отдачу может испытать лишь весь кристалл целиком. Масса кристалла на много порядков больше массы ядра, а значит и величина R становится пренебрежимо малой. В процессах испускания и поглощения гамма-квантов без отдачи энергии фотонов равны с точностью до естественной ширины спектральной линии.
48)Состав и характеристика ядра
Атомные ядра различных элементов состоят из двух частиц– протоновинейтронов.
Протон (p) обладает зарядом + е. и массойmp = 1,67262·10–27 кг.
Протон имеет спин, равный половине (s = 1/2).
Нейтрон (n). Его электрический заряд равен нулю, а масса близка к массе протона
mn = 1,67493·10–27 кг или mn = 939,56563 МэВ. Нейтрон обладает спином, равным половине (s = ½)
Для характеристики атомных ядер вводится ряд обозначений. Число протонов, входящих в состав атомного ядра, обозначают символом Z и называют зарядовым числом или атомным номером (это порядковый номер в периодической таблице Менделеева). Заряд ядра равен Ze, где e – элементарный заряд. Число нейтронов обозначают символом N. Общее число нуклонов (т. е. протонов и нейтронов) называют массовым числом A: A = Z + N. Ядра химических элементов обозначают символом 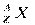 , где X – химический символ элемента. Например,
, где X – химический символ элемента. Например, 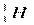 - водород,
- водород, 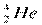 - гелий. Ядра одного и того же химического элемента могут отличаться числом нейтронов. Такие ядра называются изотопами.
- гелий. Ядра одного и того же химического элемента могут отличаться числом нейтронов. Такие ядра называются изотопами.
Дейтерий обозначают также символом D, а тритий — символом Т. Протий и дейтерий стабильны, тритий радиоактивен.
Ядра с одинаковым массовым числом А называются изобарами. В качестве примера можно привести  и
и  . Ядра с одинаковым числом нейтронов N = A — Z носят название изотонов (
. Ядра с одинаковым числом нейтронов N = A — Z носят название изотонов ( 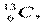
 ). Радиоактивные ядра с одинаковыми Z и А, отличающиеся периодом полураспада называются изомерами.
). Радиоактивные ядра с одинаковыми Z и А, отличающиеся периодом полураспада называются изомерами.
49)Масса и энергия связи ядра. Масса ядраизмеряется в атомных единицах массы (а.е.м). За одну атомную единицу массы принимается 1/12 часть массы нейтрального атома углерода 12 С:
1а.е.м = 1.6606 10-27 кг. А.е.м. выражается через энергетические единицы:
1а.е.м = 1.510-3 эрг = 1.510-10Дж = 931.49 МэВ
Энергия связи ядраEсв(A,Z) это минимальная энергия, необходимая, чтобы развалить ядро на отдельные, составляющие его нуклоны.
Есв(A, Z) = [Z mp + (A - Z)mn - M(A, Z)]c2,
где Z - число протонов, ( A - Z) - число нейтронов, mp - масса протона, mn - масса нейтрона, М(A,Z) - масса ядра с массовым числом А и зарядом Z.
Энергия связи ядра, выраженная через массу атома Mат, имеет вид:
Есв(A, Z) = [ZmH + (A - Z)mn - Mат(A, Z)]c2 ,
где mH - масса атома водорода.
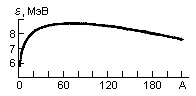 Рис. 1 Рис. 1
|
Удельная энергия связи ядра ε(A, Z) это энергия связи, приходящаяся на один нуклон
ε(A, Z) = Eсв(A,Z) / A.
На рис. 1 показана зависимость удельной энергии связи ядра ε от числа нуклонов A. Видно, что наиболее сильно связаны ядра в районе железа и никеля (A ~ 55-60). Такой ход зависимости ε(A) показывает, что для легких ядер энергетически выгодны реакции синтеза более тяжелых ядер, а тяжелых - деление на более легкие осколки.
50)Оболочечная модель.
Её прообразом является многоэлектронный атом. Согласно этой модели, каждый нуклон находится в ядре в определённом индивидуальном квантовом состоянии, характеризуемом энергией, моментом вращения j его проекцией m на одну из координатных осей и орбитальным моментом вращения l = j± 1/2 [чётность состояния нуклона P = (—1) l]. Энергия уровня не зависит от проекции момента вращения на внешнюю ось. Поэтому в соответствии с Паули принципом на каждом энергетическом уровне с моментами j, l может находиться (2j + 1) тождественных нуклонов (протонов и нейтронов), образующих «оболочку» (j, l). Важным результатом модели оболочек даже в простейшей форме (без учёта взаимодействия квазичастиц) является получение квантовых чисел основных состояний нечётных ядер и приближённое описание данных о магнитных дипольных моментах таких ядер.
Ротационная модель. 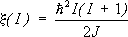
Согласно экспериментальным данным в области массовых чисел 150 < A < 190 и А > 200, квадрупольные моменты Q ядер c I>1/2 чрезвычайно велики, они отличаются от значений, предсказываемых оболочечной моделью, в 10—100 раз. Согласно этой модели, ядро представляет собой эллипсоид вращения Его большая (a1) и малая (a2) полуоси выражаются через параметр деформации b ядра соотношениями: 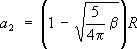
Описанные ядерные модели являются основными, охватывающими свойства большинства ядер. Они, однако, не достаточны для описания всех наблюдаемых свойств основных и возбуждённых состояний ядер. Так, в частности, для объяснения спектра коллективных возбуждений сферических ядер привлекается модель поверхностных и квадрупольных колебаний жидкой капли, с которой отождествляется ядро (вибрационная модель). Для объяснения свойств некоторых ядер используются представления о кластерной (блочной) структуре Ядра.
51) ЯДЕРНЫЕ СИЛЫ - силы взаимодействия между нуклонами; обеспечивают большую величину энергии связи ядер по сравнению с др. системами. Я. с. являются наиб. важным и распространённым примером сильного взаимодействия (СВ). Когда-то эти понятия были синонимами и сам термин "сильное взаимодействие" был введён для подчёркивания огромной величины Я. с. по сравнению с др. известными в природе силами: эл--магн., слабыми, гравитационными. После открытия p- , r- и др. мезонов, гиперо-нов и др. адронов термин "сильное взаимодействие" стали применять в более широком смысле - как взаимодействие адронов. В 1970-х гг. квантовая хромодинамика (КХД) утвердилась как общепризнанная микроскопич. теория СВ. Согласно этой теории, адроны являются составными частицами, состоящими из кварков и глюонов, а под СВ стали понимать взаимодействие этих фундам. частиц.
Основой Я. с. является сильное взаимодействие нуклонов. Сильное взаимодействие нуклонов в ядрах отличается от взаимодействия свободных нуклонов, однако последнее является фундаментом, на к-ром строится вся ядерная физика и теория Я. с. Это взаимодействие обладает изотопической инвариантностью. Суть её в том, что взаимодействие между 2 нейтронами, 2 протонами или между протоном и нейтроном в одинаковых кван
Последнее изменение этой страницы: 2016-07-22
lectmania.ru. Все права принадлежат авторам данных материалов. В случае нарушения авторского права напишите нам сюда...