
Категории:
ДомЗдоровьеЗоологияИнформатикаИскусствоИскусствоКомпьютерыКулинарияМаркетингМатематикаМедицинаМенеджментОбразованиеПедагогикаПитомцыПрограммированиеПроизводствоПромышленностьПсихологияРазноеРелигияСоциологияСпортСтатистикаТранспортФизикаФилософияФинансыХимияХоббиЭкологияЭкономикаЭлектроника
Первые попытки систематизации элементов
Одной из важнейших проблем теоретической химии XIX века после разрешения проблемы атомных весов оставалась систематизация химических элементов, число которых постоянно росло. Создание периодической системы химических элементов стало результатом многолетней работы многих химиков.
Первую попытку систематизации элементов предпринял немецкий химик Иоганн Вольфганг Дёберейнер, сформулировавший в 1829 г. закон триад. Дёберейнер обратил внимание на то, что в рядах сходных по свойствам элементов наблюдается закономерное изменение атомной массы.
Необходимым этапом систематизации элементов стала их химическая классификация, важнейший вклад в которую внёс немецкий химик Леопольд Гмелин. В 1843 г. Гмелин опубликовал таблицу химически сходных элементов, расставленных по группам в порядке возрастания "соединительных масс". Вне групп элементов, вверху таблицы, Гмелин поместил три "базисных" элемента – кислород, азот и водород. Под ними были расставлены триады, а также тетрады и пентады
Следующим шагом на пути к открытию периодического закона стали дифференциальные системы, направленные на выявление общих закономерностей в изменении атомного веса элементов. В 1850 г. немецкий врач Макс фон Петтенкофер попытался найти у элементов соотношения, подобные тем, что обнаруживаются в гомологических рядах, т.е. в рядах соединений, отличающихся друг от друга группой CH2.
Таблица Штреккера, 1859 г.
Дальнейшим развитием дифференциальных систем стали периодические классификации 1860-х годов. Александр Эмиль Бегуйе де Шанкуртуа в 1862 г. предложил винтовой график элементов, расположенных в порядке возрастания атомных весов –"земная спираль"
Джон Александр Рейна Ньюлендс в 1864 г. опубликовал таблицу элементов, отражающую предложенный им закон октав. Ньюлендс показал, что в ряду элементов, размещённых в порядке возрастания атомных весов, свойства восьмого элемента сходны со свойствами первого. Такая зависимость действительно имеет место для лёгких элементов, однако Ньюлендс пытается придать ей всеобщий характер.Таблица Ньюлендса, 1864 г.
В том же году Уильям Одлинг, пересмотрев предложенную им в 1857 г. систематику элементов, основанную на эквивалентных весах, предложил следующую таблицу, не сопровождаемую какими-либо пояснениями Таблица Одлинга 1864 г.
Несколько попыток систематизации элементов предпринял в 60-е годы XIX века немецкий химик Юлиус Лотар Мейер.
В 1864 г. Мейер опубликовал в своей книге таблицу, в которую были включены 28 элементов, размещённые в шесть столбцов согласно их валентностям.
Объединённая таблица, подготовленная им в 1868 г. для второго издания своей книги, была опубликована лишь в 1895 г.; в ней 52 элемента размещались в 15 столбцах. Следующую таблицу Мейер предложил в вышедшей в 1870 г. статье, содержавшая также график зависимости атомного объёма элемента от атомного веса, имеющий характерный пилообразный вид.
43.Периодический закон и таблица Менделеева
Важнейший вклад в систематизацию элементов внёс русский химик Дмитрий Иванович Менделеев, который в марте 1869 г. представил Русскому химическому обществу периодический закон химических элементов, изложенный в нескольких основных положениях:
1. Элементы, расположенные по возрастанию их атомного веса, представляют явственную периодичность свойств;
2. Сходные по свойствам элементы имеют или близкие атомные веса (Ir, Pt, Os), или последовательно и однообразно увеличивающиеся (K, Rb, Cs);
3. Сопоставление элементов или их групп по величине атомного веса отвечает их т.н. атомности;
4. Элементы с малыми атомными весами имеют наиболее резко выраженные свойства, поэтому они являются типическими элементами;
5. Величина атомного веса определяет характер элемента;
6. Следует ожидать открытия ещё многих неизвестных элементов, например, сходных с Al или Si, с паем (атомной массой) 65-75;
7. Величина атомного веса элемента может быть иногда исправлена, если знать аналоги данного элемента. Так, пай Te должен быть не 128, а 123-126.
В том же 1869 г. вышло и первое издание учебника "Основы химии", в котором была приведена периодическая таблица Менделеева.
В 1871 г. Менделеев в итоговой статье "Периодическая законность химических элементов" дал формулировку Периодического закона: "Свойства элементов, а потому и свойства образуемых ими простых и сложных тел стоят в периодической зависимости от атомного веса. Тогда же Менделеев придал своей периодической таблице классический вид (т. н. короткая таблица).
44.Доработка и развитие периодического закона
Формулировка Менделеевым периодического закона и построение периодической таблицы означали лишь начало развития учения о периодичности свойств элементов. Предсказания Менделеева вначале были встречены с известным скепсисом; лишь после того, как были открыты предсказанные элементы, и обнаружено совпадение их реальных свойств с предсказанными, периодический закон был признан в качестве одного из фундаментальных законов химии. В развитии периодического закона принято выделять два этапа – химический и физический.
Химический этап развития периодического закона начался с открытия предсказанных элементов.
В 1875 г. французский химик Поль Эмиль Лекок де Буабодран открыл новый элемент, который был назван галлием. Менделеев сразу же указал, что галлий представляет собой экаалюминий. Дальнейшие исследования полностью подтвердили это, причём оказалось, что Менделеев предсказал плотность галлия точнее, чем Лекок де Буабодран экспериментально определил её.
В 1879 г. шведский химик Ларс Фредерик Нильсон опубликовал сообщение об открытии скандия, свойства которого в точности соответствовали свойствам менделеевского экабора.
В 1886 г. немецкий химик Клеменс Александр Винклер открыл германий. Исследование свойств нового элемента показало, что он полностью идентичен с экасилицием (сам Менделеев поначалу счёл новый элемент "экакадмием"; на тождественность германия и экасилиция первым указал Л. Мейер).
Полное подтверждение предсказаний Менделеева означало торжество периодического закона. С середины 1880-х годов учение о периодичности было окончательно признано в качестве одной из основ теоретической химии.
Тем не менее, в периодическом законе оставались некоторые проблемы. Предстояло определиться с местом в периодической таблице для двух групп элементов – инертных газов, имеющих нулевую валентность, и тринадцати редкоземельных элементов. Нельзя не упомянуть о том, что открытие большого числа элементов во второй половине XIX века было в значительной мере обусловлено появлением спектрального анализа, метода, который предложили в конце 1850-х годов немецкие учёные Густав Роберт Кирхгоф и Роберт Вильгельм Бунзен. В 1900-1902 гг. Д. И. Менделеев, Уильям Рамзай, первооткрыватель инертных газов, и Богуслав Браунер, известный своими работами по уточнению атомных масс химических элементов, произвели модернизацию периодической таблицы. Менделеев и Рамзай пришли к выводу о необходимости образования в таблице нулевой группы элементов, в которую вошли инертные газы. Нулевая группа прекрасно вписалась в периодическую таблицу; инертный газ явился элементом, переходным между галогенами и щелочными металлами. Браунер предложил решение проблемы размещения в таблице редкоземельных элементов.
Модернизация периодической системы в начале XX века завершила химический этап её развития. Химия в принципе не могла объяснить причину периодичности свойств элементов и их соединений. Дальнейшее развитие периодического закона в XX веке связано с блестящими успехами физики, приведшими к революционным изменениям в естествознании.
ОТКРЫТИЕ РАДИОАКТИВНОСТИ
Французский физик А.Баккрель 1 марта 1896 года обнаружил по почернению фотопластинки испускание солью урана невидимых лучей сильной проникающей способности. Вскоре он выяснил, что свойством лучеиспускания обладает и сам уран. Затем такое свойство им было обнаружено и у тория. Радиоактивность (от латинского radio – излучаю, radus – луч и activus – действенный), такое название получило открытое явление, которое оказалось привилегией самых тяжелых элементов периодической системы Д.И.Менделеева
Есть несколько определений этого замечательного явления одно из которых дает такую ее формулировку: «Радиоактивность – это самопроизвольное (спонтанное) превращение неустойчивого изотопа химического элемента в другой изотоп (обычно изотоп другого элемента); при этом происходит испускание электронов, протонов, нейтронов или ядер гелия ( L -частиц)» Сущностью открытого явления было в самопроизвольном изменении состава атомного ядра, находящегося в основном состоянии либо в возбужденном долгоживущем состоянии
В 1898 году другие французские ученые Мария Склодовская-Кюри и Пьер Кюри выделили из уранового минерала два новых вещества, радиоактивных в гораздо большей степени, чем уран и торий. Так были открыты два неизвестных ранее радиоактивных элемента - полоний и радий, В 1903 году за открытие в области радиоактивности супругам Кюри и А.Беккерею была присуждена Нобелевская премия по физике
В 1898 году английский ученый Э.Резерфорд приступил к изучению явления радиоактивности. В 1903 году Э.Резерфорд доказывает ошибочность предположения английского физика Д.Томпсона о его теории строении атома и в 1908- 1911 г .г. проводит опыты по рассеянию L – частиц (ядер гелия) металлической фольгой.. Так в науку о радиоактивности впервые вошло понятие об L – и B - лучах. Немного позже была обнаружена еще одна составляющая часть излучения, обозначенная третьей буквой греческого алфавита: Y лучи. В 1901-1903 годах он совместно с английским ученым Ф.Содди проводит исследования, которые привели к открытию естественного превращения элеентов ( например радия в радон) и разработке теории радиоактивного распада атомов
В 1903 году немецкий физик К.Фаянс и Ф.Содди независимо друг от друга сформулировали правило смещения, характеризующее перемещение изотопа в периодической системе элементов при различных радиоактивных превращениях
Весной 1934 года в «Докладах Парижской академии наук» появилась статья под названием «Новый тип радиоактивности». Ее авторы Ирен Жолио-Кюри и ее муж Фредерик Жолио-Кюри обнаружили, что бор, магний, и алюминий, облученные L – частицами, становятся сами радиоактивными и при своем распаде испускают позитроны. Так была открыта искусственная радиоактивность. В 1934 г . И. и Ф. Жолио-Кюри в результате изучения искусственной радиации были открыты новые варианты B– распада – испускание позитронов. И. и Ф. Жолио-Кюри осуществили ядерную реакцию, продуктом которой был радиоактивный изотоп фосфора с массовым числом 30. Выяснилось, что он испускал позитрон . Этот тип радиоактивных превращений называют B + распадом (подразумевая под B - распадом испускание электрона)
Один из выдающихся ученых современности Э.Ферми , свои главные работы посвятил исследованиям, связанным с искусственной радиоактивностью. Созданная им в 1934 году теория бетта-распада и в настоящее время используется физиками для познания мира элементарных частиц
Одним из первых ученых в бывшем СССР, который приступил к изучению физики атомных ядер вообще и радиоактивности в частности был академик И.В.Курчатов. В 1934 году он открыл явление разветвления ядерных реакций, вызываемых нейтронной бомбардировкой и исследовал искусственную радиоактивность ряда химических элементов. В 1935 году при облучении брома потоками нейтронов Курчатов и его сотрудники заметили, что возникающие при этом радиоактивные атомы брома распадаются с двумя различными скоростями. Такие атомы назвали изомерами, а открытое учеными явление изомерией
Наукой было установлено, что быстрые нейтроны способны разрушать ядра урана. При этом выделяется много энергии и образуются новые нейтроны, способные продолжать процесс деления ядер урана. Позднее обнаружилось, что атомные ядра урана могут делиться и без помощи нейтронов. Так было установлено самопроизвольное (спонтанное) деление урана
Открытие радиоактивности оказало огромное влияние на развитие науки и техники, Оно ознаменовало начало эпохи интенсивного изучения свойств и структуры веществ. Новые перспективы, возникшие в энергетике, промышленности, военной области медицине и других областях человеческой деятельности благодаря овладению ядерной энергией, были вызваны к жизни обнаружением способности химических элементов к самопроизвольным превращениям. Однако, наряду с положительными факторами использования свойств радиоактивности в интересах человечества можно привести примеры и негативного их вмешательства в нашу жизнь. К числу таких может относиться ядерное оружие во всех его формах, затонувшие корабли и подводные лодки с атомными двигателями и атомным оружием, захоронение радиоактивных отходах в море и на земле, аварии на атомных электростанциях и др. а непосредственно для Украины использование радиоактивности в атомной энергетике привело к Чернобыльской трагедии
46.Новые представления о строении атома
Модели строения атома
Первые модели строения атома появились в самом начале XX века. Жан Перрен в 1901 г. высказал предположение о ядерно-планетарном устройстве атома. Подобную же модель предложил в 1904 г. японский физик Хантаро Нагаока. В модели Нагаоки атом уподоблялся планете Сатурн; роль планеты выполнял положительно заряженный шар, представляющий собой основную часть объёма атома, а электроны располагались подобно спутникам Сатурна, образующим его кольца. Однако более широкое распространение получила т.н. кексовая модель атома: в 1902 г. Уильям Томсон (лорд Кельвин) высказал предположение о том, что атом представляет собой сгусток положительно заряженной материи, внутри которого равномерно распределены электроны. Немецкий физик Филипп фон Ленард попытался создать модель, не предполагающую раздельного существования в атоме противоположных зарядов. Атом, согласно модели Ленарда, состоит из нейтральных частиц (т.н. динамид), каждая из которых является электрическим дуплетом.
| Первые модели строения атома: | |
 У. Томсон, 1902 г. У. Томсон, 1902 г.
|  Дж. Дж. Томсон, 1904 г. Дж. Дж. Томсон, 1904 г.
|
 Ф. Ленард, 1904 г. Ф. Ленард, 1904 г.
|  Х. Нагаока, 1904 г. Х. Нагаока, 1904 г.
|
В 1906-1909 гг. Ганс Гейгер, Эрнст Марсден и Эрнест Резерфорд, пытаясь найти экспериментальные подтверждения модели Томсона, провели свои знаменитые опыты по рассеиванию α-частиц на золотой фольге.
Резерфорд в 1911 г. предложил свою ядерную модель атома: в центре атома находится положительно заряженное ядро, объём которого ничтожно мал по сравнению с размерами атома; вокруг ядра вращаются электроны, число которых приблизительно равно половине атомной массы элемента. Модель атома Резерфорда при несомненных достоинствах содержала важное противоречие: в соответствии с законами классической электродинамики вращающийся вокруг ядра электрон должен был непрерывно испускать электромагнитное излучение, теряя энергию. Вследствие этого радиус орбиты электрона должен был быстро уменьшаться, и рассчитанное из этих представлений время жизни атома оказывалось ничтожно малым. Тем не менее, модель Резерфорда послужила основой для создания принципиально новой теории, которую разработал в 1913 г. датский физик Нильс Хенрик Давид Бор.
Модель Бора опиралась на квантовую гипотезу, которую выдвинул в 1900 г. немецкий физик Макс Карл Эрнст Людвиг Планк. Планк постулировал, что вещество может испускать энергию излучения только конечными порциями, пропорциональными частоте этого излучения. Применив квантовую гипотезу для объяснения фотоэффекта, Альберт Эйнштейн в 1905 г. предложил фотонную теорию света.
Ещё одной предпосылкой для боровской модели атома стали серии спектральных линий водорода, которые обнаружили в 1885 г. швейцарский ученый Иоганн Якоб Бальмер, в 1906 г. американский физик Теодор Лайман и в 1909 г. немецкий физик Фридрих Пашен. Эти серии (в видимой, ультрафиолетовой и инфракрасной областях спектра) подчинялись очень простой закономерности: частоты были пропорциональны разности обратных квадратов целых чисел.
Бор объяснил устойчивость планетарной модели атома и одновременно эти спектральные данные с позиций квантовой теории, сформулировав ряд постулатов, накладывающих на модель атома квантовые ограничения. Согласно постулатам Бора, электрон может вращаться вокруг ядра лишь по некоторым дозволенным ("стационарным") орбитам, находясь на которых, он не излучает энергию. Ближайшая к ядру орбита соответствует "нормальному" (наиболее устойчивому) состоянию атома. При сообщении атому кванта энергии электрон переходит на более удалённую орбиту. Обратный переход из "возбуждённого" в "нормальное" состояние сопровождается испусканием кванта излучения.

| 
|
Как показал расчёт на основании спектральных данных, радиусы электронных орбит относятся как 12 : 22 : 32 : … : n2. Иначе говоря, момент количества движения вращающегося электрона пропорционален целочисленному главному квантовому числу (номеру орбиты).
Максимально возможное число электронов на каждом уровне равно удвоенному квадрату главного квантового числа; это число оказалось равным количеству элементов в периодах периодической таблицы. Модель Бора, таким образом, выявила несомненную связь периодичности свойств элементов со строением электронных оболочек атомов.
Для атома водорода расчёты спектров на основе модели Бора дали хорошее согласие с экспериментом, но для других элементов получалось существенное расхождение с опытными данными. В 1916 г. немецкий физик Арнольд Иоганн Вильгельм Зоммерфельд уточнил модель Бора. Зоммерфельд высказал предположение, что кроме круговых, электрон может двигаться и по эллиптическим орбитам. При этом почти одинаковому уровню энергии соответствует число типов орбит, равное главному квантовому числу. Зоммерфельд дополнил модель побочным (орбитальным) квантовым числом (определяющим форму эллипсов) и зависимостью массы электрона от скорости. Основываясь на модели атома Бора-Зоммерфельда, представляющей собой компромисс между классическими и квантовыми представлениями (в классическую картину вводились квантовые ограничения), Нильс Бор в 1921 г. заложил основы формальной теории периодической системы. Причина периодичности свойств элементов, по мнению Бора, заключалась в периодическом повторении строения внешнего электронного уровня атома.
В первой половине 1920-х гг. в модель атома были добавлены ещё два квантовых числа. Немецкий физик Альфред Ланде ввёл для описания движения электрона в атоме магнитное квантовое число, а молодые физики Джордж Юджин Уленбек и Сэмюэл Абрахам Гаудсмит в 1925 г. ввели в атомную физику представление о спине электрона, Следует отметить, что американский физик Артур Холли Комптон, основываясь на атомных спектрах высокого разрешения, ещё в 1921 г. высказывал предположение о квантованном вращении электрона, а в следующем году Отто Штерн и Вальтер Герлах экспериментально наблюдали разделение пучка атомов серебра в магнитном поле на две части, соответствующие ориентации электронных спинов.
В 1925 г. Вольфганг Паули опубликовал свою работу, содержащую формулировку принципа запрета, носящего его имя: в данном квантовом состоянии может находиться только один электрон. Паули указал, что для характеристики состояния электрона необходимо четыре квантовых числа: главное квантовое число n, азимутальное квантовое число l и два магнитных числа m1 и m2.
В 1927 г. немецкий физик Фридрих Хунд сформулировал эмпирические правила заполнения электронных оболочек. С применением запрета Паули и принципа насыщения уровней к 1927 г. была в целом построена электронная структура всех известных к тому времени 92 элементов. Создание учения о строении электронных оболочек атомов позволило разработать формальную физическую теорию периодической системы, объяснившую причины периодичности свойств элементов и их соединений, а также создать первые теории химической связи.
47.Экспериментальная проверка атомно-молекулярной теории
48.Изотопия и ядерные реакции
48. Я́дерная реа́кция — процесс образования новых ядер или частиц при столкновениях ядер или частиц. Впервые ядерную реакцию наблюдал Резерфорд в 1919 году, бомбардируя α-частицами ядра атомов азота, она была зафиксирована по появлению вторичных ионизирующих частиц, имеющих пробег в газе больше пробега α-частиц и идентифицированных как протоны. Впоследствии с помощью камеры Вильсона были получены фотографии этого процесса.
По механизму взаимодействия ядерные реакции делятся на два вида:
- реакции с образованием составного ядра, это двухстадийный процесс, протекающий при не очень большой кинетической энергии сталкивающихся частиц (примерно до 10 МэВ).
- прямые ядерные реакции, проходящие за ядерное время, необходимое для того, чтобы частица пересекла ядро. Главным образом такой механизм проявляется при очень больших энергиях бомбардирующих частиц.
Если после столкновения сохраняются исходные ядра и частицы и не рождаются новые, то реакция является упругим рассеянием в поле ядерных сил, сопровождается только перераспределением кинетической энергии и импульса частицы и ядра-мишени и называется потенциальным рассеянием
Изотопия
Изотопия — это гомотопия  , для которой при любом t отображение ft является гомеоморфизмом X на
, для которой при любом t отображение ft является гомеоморфизмом X на 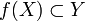 .
.
- Если пространства гомеоморфны, то они изотопически эквивалентны, однако есть негомеоморфные пространства одного изотопического типа, например n-мерный шар и такой же шар с приклеенным к его поверхности (одним своим концом) отрезком.
- Любой гомотопический инвариант является изотопическим инвариантом, но существуют изотопические инварианты, например размерность, не являющиеся гомотопическими.
Свойства
- Гладкая изотопия всегда продолжается до гладкой накрывающей изотопии
- Существуют диффеоморфизмы сферы Sn на себя, неизотопные тождественному, этот факт связан с существованием нетривиальных дифференциальных структур на сферах размерности n + 1.
49.Химические журналы в России в 19-20-х в.в.
50.Химия в России в 19-20-х в. в.
51.Приоритеты развития химии в России 19-20 в.в.
52.Казанская научная школа химиков
История науки особо фиксирует эту последовательность. Здесь, на берегах великой Волги, в городе, где "встретились Восток и Запад", возник в начале XIX века университет, ставший крупным научным центром России.
| Здесь, в химической лаборатории Казанского университета, возникла в середине века научная школа, давшая миру целую плеяду замечательных ученых, труды которых составляют золотой фонд мировой химической науки. К.К.Клаус, Н.Н.Зинин, А.М.Бутлеров, В.В.Марковников, А.Н.Попов, Ф.М.Флавицкий, А.М.Зайцев, Е.Е.Вагнер, А.А.Альбицкий, С.Н.Реформатский, А.Н.Реформатский, А.Е.Арбузов, А.И.Разумов, Г.Х.Камай, Б.А.Арбузов, А.И.Пудовик, В.С.Абрамов, А.И.Коновалов, А.Н.Верещагин - вот перечень выдающихся имен, составляющих "основную линию" школы. |
| "Колыбель русской органической химии", - так определили историки химии Казань, химическую лабораторию Казанского университета.
Н.Н.Зинин, а позднее и А.М.Бутлеров, будучи избранными академиками Петербургской Академии наук, в соответствии с традициями того времени перенесли свои исследования из Казани в Санкт-Петербург. Возникла "Петербургская ветвь" Казанской химической школы. В.В.Марковников, покинув Казанский университет, продолжил исследования в Новороссийском (ныне Одесском), а затем в Московском университете. Образовалась "ветвь Московская". Ученики А.М.Бутлерова, а позднее ученики А.М.Зайцева возглавили кафедры химии и в других российских университетах: А.Н.Попов, Е.Е.Вагнер - в Варшаве, С.Н.Реформатский - в Киеве, А.А.Альбицкий - в Харькове... Воистину "колыбель", воистину "химическая могучая кучка". Начало Казанской химической школы положили труды двух замечательных ученых : К.К.Клауса, открывшего в 1844 г. элемент рутения, и Н.Н.Зинина, осуществившего превращение нитробензола в анилин, что положило начало промышленному органическому синтезу. Славу своих учителей приумножил выпускник Казанского университета - А.М.Бутлеров (1828-1886), создавший теорию химического строения органических соединений, и наиболее выдающиеся его ученики: В.В.Марковников, А.Н.Попов, Ф.М.Флавицкий, А.М.Зайцев. Ученые Казанского университета высоко оценили научные достижения своих коллег. К.К.Клаус, Н.Н.Зинин, А.М.Бутлеров, А.М.Зайцев были избраны почетными членами Казанского университета. По решению Совета университета в аудитории, именуемой ныне Бутлеровской, установлены бюсты Н.Н.Зинина и А.М.Бутлерова. Прекрасный педагог А.М.Зайцев воспитал плеяду химиков-органиков. Среди них: Е.Е.Вагнер, А.А.Альбицкий, С.Н.Реформатский, А.Н.Реформатский, И.И.Канонников, А.Е.Арбузов и др. С именем А.Е.Арбузова, возглавившего в 1911 г. кафедру органической химии Казанского университета, связано возникновение всемирно известной "арбузовской" школы химиков-фосфорооргаников. Непосредственные ученики А.Е.Арбузова: А.И.Разумов, Г.X.Камай, Б.А.Арбузов, В.С.Абрамов - первые наиболее замечательные ее представители. Школа дала ответвления. Г.X.Камай развил химию мышьякорганических соединений. Сегодня во главе многочисленного отряда казанских фосфорооргаников ученик и сподвижник Б.А.Арбузова - А.Н.Пудовик. В 1928 г. в Казани состоялся V с'езд ВХО им. Д.И.Менделеева, отметивший 100-летие со дня рождения А.М.Бутлерова. С'езд принял решение об учреждении при Казанском университете научно-исследовательского химического института, носящего имя великого химика. В 1929 г. институт был создан. А.Е.Арбузов стал его директором. |
| В 1930 г. был открыт Казанский химико-технологический институт (ныне государственный технологический университет). В 1946 г. - открыт Казанский филиал Академии наук СССР (ныне Казанский научный центр Российской Академии наук). В составе филиала был создан химический институт. Сегодня Казанский химический институт Российской АН является институтом органической и физической химии имени А.Е.Арбузова. |
| В течение последних, более, чем тридцати, лет главой казанских химиков был Б.А.Арбузов (1903-1991). Он преемник отца по кафедре органической химии Казанского университета, по НИХИ им. А.М.Бутлерова. Весом научный вклад учеников и последователей Б.А.Арбузова. Среди учеников Б.А.Арбузова член-корреспондент Российской Академии наук и почетный академик Академии наук Татарстана, лауреат Ленинской премии А.Н.Пудовик - один из лидеров в области химии фосфороорганических соединений; член-корреспондент Российской Академии наук и почетный академик Академии наук Татарстана, лауреат Государственной премии СССР П.А.Кирпичников - крупный специалист в области высокомолекулярных соединений; академик Российской Академии наук и Академии наук Татарстана, лауреат Государственной премии СССР А.И.Коновалов - исследователь реакционной способности непредельных систем и межмолекулярных взаимодействий: профессор А.Н.Верещагин - известен своими работами по изучению пространственного строения органических соединений и внутримолекулярных взаимодействий. Сегодня Казань стала крупным химическим центром, сотни химиков трудятся в лабораториях высших учебных заведений, исследовательских учреждениях. В составе Академии наук Татарстана есть отделение химии и химической технологии. |
53.Петербургский научный центр
Санкт-Петербургский научный центр РАН — объединение научных учреждений Российской Академии наук (РАН) в Санкт-Петербурге и Ленинградской области.
Основан в 1984 г. как Ленинградский научный центр (ЛНЦ, сейчас СПбНЦ РАН). Продолжает научные традиции, заложенные Петром I в начале XVIII века[1].
Первым председателем СПбНЦ стал академик И. А. Глебов. С 1989 г. Президиум Научного центра возглавляет академик Ж. И. Алфёров.
В 1725 г. в Петербурге была основала Академия наук. На первых норах ее членами были зарубежные молодые ученые (Л. Эйлер, Д. Бернулли и др.), которые выполнили уже в первые годы своей деятельности выдающиеся исследования, благодаря чему Петербуржская академия скоро приобрела широкую известность и авторитет в научных кругах Западной Европы. На кафедре химии Академии с 1741 г. начал работать Михаил Васильевич Ломоносов.
54. Химия в первой половине 20 в.
ДВАДЦАТЫЙ ВЕК
Новая структурная теория. С развитием физических теорий о строении атомов и молекул были переосмыслены такие старые понятия, как химическое сродство и трансмутация. Возникли новые представления о строении материи.
Новые методы исследования. Все новые представления о строении вещества могли формироваться только в результате развития в 20 в. экспериментальной техники и появления новых методов исследования. Открытие в 1895 Вильгельмом Конрадом Рентгеном (1845-1923) Х-лучей послужило основой для создания впоследствии метода рентгеновской кристаллографии, позволяющей определять структуру молекул по картине дифракции рентгеновских лучей на кристаллах. С помощью этого метода была расшифрована структура сложных органических соединений - инсулина, дезоксирибонуклеиновой кислоты (ДНК), гемоглобина и др. С созданием атомной теории появились новые мощные спектроскопические методы, дающие информацию о строении атомов и молекул. Различные биологические процессы, а также механизм химических реакций исследуются с помощью радиоизотопных меток; широкое применение радиационные методы находят и в медицине.
Биохимия. Эта научная дисциплина, занимающаяся изучением химических свойств биологических веществ, сначала была одним из разделов органической химии. В самостоятельную область она выделилась в последнее десятилетие 19 в. в результате исследований химических свойств веществ растительного и животного происхождения. Одним из первых биохимиков был немецкий ученый Эмиль Фишер (1852-1919). Он синтезировал такие вещества, как кофеин, фенобарбитал, глюкоза, многие углеводороды, внес большой вклад в науку о ферментах - белковых катализаторах, впервые выделенных в 1878. Формированию биохимии как науки способствовало создание новых аналитических методов. В 1923 шведский химик Теодор Сведберг (1884-1971) сконструировал ультрацентрифугу и разработал седиментационный метод определения молекулярной массы макромолекул, главным образом белков. Ассистент Сведберга Арне Тизелиус (1902-1971) в том же году создал метод электрофореза - более совершенный метод разделения гигантских молекул, основанный на различии в скорости миграции заряженных молекул в электрическом поле. В начале 20 в. русский химик Михаил Семенович Цвет (1872-1919) описал метод разделения растительных пигментов при прохождении их смеси через трубку, заполненную адсорбентом. Метод был назван хроматографией. В 1944 английские химики Арчер Мартин (р. 1910) и Ричард Синг (р. 1914) предложили новый вариант метода: они заменили трубку с адсорбентом на фильтровальную бумагу. Так появилась бумажная хроматография - один из самых распространенных в химии, биологии и медицине аналитических методов, с помощью которого в конце 1940-х - начале 1950-х годов удалось проанализировать смеси аминокислот, получающиеся при расщеплении разных белков, и определить состав белков. В результате кропотливых исследований был установлен порядок расположения аминокислот в молекуле инсулина (Фредерик Сенгер, 1953), а к 1964 этот белок удалось синтезировать. Сейчас методами биохимического синтеза получают многие гормоны, лекарственные средства, витамины.
55. Химия во второй половине 20в. И на рубеже веков
Квантовая химия
Для того, чтобы объяснить устойчивость атома, Нильс Бор соединил в своей модели классические и квантовые представления о движении электрона. Однако искусственность такого соединения была очевидна с самого начала. Развитие квантовой теории привело к изменению классических представлений о структуре материи, движении, причинности, пространстве, времени и т.д., что способствовало коренному преобразованию картины мира. В конце 20-х – начале 30-х годов XX века на основе квантовой теории сформировались принципиально новые теории строения атома и образования химической связи.
После создания Альбертом Эйнштейном фотонной теории света (1905) и выведения им статистических законов электронных переходов в атоме (1917) в физике обострилась проблема "волна – частица". Если в XVIII–XIX веках имелись расхождения между различными учёными, которые для объяснения одних и тех же явлений в оптике привлекали либо волновую, либо корпускулярную теорию, то теперь противоречие приобрело принципиальный характер: одни явления (дифракция) интерпретировались с волновых позиций, а другие (фотоэффект) – с корпускулярных.
ЗАКЛЮЧЕНИЕ
К середине 30-х годов XX века химическая теория приобретает вполне современный вид. Хотя основные концепции химии в дальнейшем стремительно развивались, принципиальных изменений в теории больше не происходило.
Следует отметить, что всё сказанное в предыдущей главе об истории установления строения атома и природы связи между атомами является историей не только и не столько химии, сколько физики и естествознания вообще. Установление делимости атома, квантовой природы излучения, создание теории относительности и квантовой механики представляли собой революционный переворот в понимании окружающих человека физических явлений. Этот переворот коснулся прежде всего микро- и мегамира, что к химии в классическом смысле, казалось бы, не имеет прямого отношения. Однако в этом и заключается одна из особенностей химии XX века: для понимания причин, которыми обусловлены фундаментальные химические законы, потребовалось выйти за пределы предмета химии. Ныне теоретическая химия в значительной степени представляет собой физику (прежде всего термодинамику и атомную физику), "адаптированную" для решения химических задач. В значительной степени именно достижения физики сделали возможными огромные успехи теоретической и прикладной химии в XX столетии.
Изложение содержательной части современной химии в кратком историческом очерке вряд ли возможно вследствие колоссального объёма информации. Быть может, имело бы смысл привести обзор основных этапов, однако этот обзор ни в коей мере не мог бы претендовать на полноту. Химия в XX веке чрезвычайно усложнилась и расширилась по сравнению с классическим периодом. Объём химических знаний стал настолько велик, что составление краткого, в несколько страниц, очерка новейшей истории химии представляет собой сложнейшую задачу, взяться за которую автор настоящей работы не считает для себя возможным.
Тем не менее, необходимо выделить основные черты современной химии, отличающие её от классической химии второй половины XIX века.
Прежде всего, создание надёжного теоретического фундамента привело к значительному росту возможностей прогнозирования свойств вещества. Современная химия немы
Последнее изменение этой страницы: 2016-08-29
lectmania.ru. Все права принадлежат авторам данных материалов. В случае нарушения авторского права напишите нам сюда...