
Категории:
ДомЗдоровьеЗоологияИнформатикаИскусствоИскусствоКомпьютерыКулинарияМаркетингМатематикаМедицинаМенеджментОбразованиеПедагогикаПитомцыПрограммированиеПроизводствоПромышленностьПсихологияРазноеРелигияСоциологияСпортСтатистикаТранспортФизикаФилософияФинансыХимияХоббиЭкологияЭкономикаЭлектроника
Типы индикаторных электродов в потенциометрии
Электроды первого рода. Металл в контакте с раствором собственного иона, например Ag|Ag+.
Для электродов первого рода потенциалопределяющее равновесие на границе раздела фаз имеет вид
Mn+ + ne– = M0.
Уравнение Нернста для электродного потенциала:
 ,
,
где  – активность иона металла. Поскольку потенциал электрода этого типа обусловлен электрообменными равновесиями, он зависит и от других окислительно-восстановительных пар в растворе.
– активность иона металла. Поскольку потенциал электрода этого типа обусловлен электрообменными равновесиями, он зависит и от других окислительно-восстановительных пар в растворе.
Электроды второго рода. Металл в равновесии с насыщенным раствором соли металла и избытком аниона, например Ag|AgCl, Cl– (хлоридсеребряный электрод).
Потенциал электрода второго рода (например, Ag|AgCl, KCl) также возникает в результате окислительно-восстановительного процесса:
| AgCl + e = Ag + Cl– | (2.2) |
Концентрация хлорид-иона определяется произведением растворимости:
| AgCl(тв) ↔ Ag+ + Cl–, ПР = 1,8 ·10–10 (25 оС), | (2.3) |
поэтому из уравнений (2.1) и (2.3) получаем
E = E0Ag + 0,05916·lgПР – 0,05916·lg[Cl–] = E0Ag, AgCl – 0,05916·lg[Сl–].
Таким образом, потенциал электрода обратимо зависит от активнос-ти хлорид-иона, в идеальном случае он изменяется на 59,16 мВ (при 25 oC) при изменении [Cl–] на порядок.
Потенциал электрода зависит от любого вещества, влияющего на активность ионов серебра: лигандов, растворяющих AgCl (таких как CN–, SCN–), веществ, образующих менее растворимые соединения с Ag+ (таких как S2–, Вг–, I–), а также сильных окислителей и восстановителей. В их присутствии хлоридсеребряный электрод нельзя погружать в исследуемый раствор, необходим солевой мостик.
Электрод характеризуется стабильным потенциалом только при условии, что концентрация хлорид-иона во внутреннем растворе поддерживается постоянной.
Электроды третьего рода. Металл в равновесии с двумя малорастворимыми солями с общим анионом (или растворимым комплексом иона второго металла) и избытком второго катиона, например Pb|PbC2O4|CaC2O4|Ca2+. С помощью такого полуэлемента можно измерить активность ионов кальция.
Окислительно-восстановительные электроды. Инертные металлы (Pt, Au) в контакте с раствором окислительно-восстановительной пары, например Pt|Fe3+, Fe2+.
Электроды из Pt, Au и графита относительно инертны и служат лишь для переноса электронов от восстановителя к окислителю в рас-творе. Величина потенциала индикаторного платинового электрода опре-деляется отношением активностей окисленной (Оx) и восстановленной (Red) форм в растворе в соответствии с уравнением Нернста:
 ,
,
где Е0 – стандартный потенциал – потенциал полуреакции при общих активностях окисленной и восстановленной форм, равных 1,0 моль/дм3.
Мембранные (ион-селективные) электроды. Ион-селективные элек-троды (ИСЭ) – полуэлементы, состоящие из ион-селективной мембраны (т.е. селективной межфазной границы), внутреннего раствора и внутрен-него электрода сравнения (стандартная конструкция) или ион-селектив-ной мембраны и твердофазного контакта (твердотельный электрод). Такой электрод позволяет селективно определять активности одних ионов в присутствии других; анализируемый раствор обычно является водным. Эти электроды отличаются от окислительно-восстановительных электродов (электродов первого, второго и третьего рода), хотя они часто содержат электрод второго рода в качестве внутреннего электрода сравнения.
Вторым полуэлементом в паре с ион-селективным электродом является внешний электрод сравнения, контакт между ними осуществляется с помощью солевого мостика. Обычно используют электроды сравнения с двойным жидкостным соединением. Схема электрохимической ячейки с ион-селективным индикаторным электродом:

Разность потенциалов, измеренная между двумя электродами сравнения, состоит из суммы локальных разностей потенциалов:
E = (Δφ1 + Δφ2 + Δφ3) + Δφj + ΔφM = Δφ0 + Δφj + EM,
гдe Δφ0 – потенциал электрода сравнения, не зависящий от концентрации определяемого иона; Δφj – потенциал жидкостного соединения; ΔφM – мембранный потенциал EM.
Мембранный потенциал EM описывает поведение ион-селективного мембранного электрода. Для мембраны, идеально селективной по отношению к определенному иону А, равновесный мембранный потенциал определяется соотношением активностей иона А в контактирующих растворах:
EM 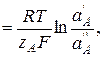
где 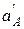 – активность иона А в растворе пробы;
– активность иона А в растворе пробы;  – активность иона А во внутреннем растворе;
– активность иона А во внутреннем растворе; 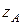 – заряд иона А.
– заряд иона А.
Поскольку 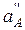 во внутреннем растворе постоянна, уравнение для потенциала мембранного электрода имеет вид
во внутреннем растворе постоянна, уравнение для потенциала мембранного электрода имеет вид
E = const + S · lg 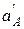 ,
,
где S – угловой коэффициент градуировочного графика (крутизна электродной функции), в идеальном случае равный нернстовскому, т.е. 59,16/zA мВ (25°С).
На практике необходимо учитывать вклад посторонних ионов В в измеряемый потенциал. Отклик мембранного электрода в реальных условиях можно успешно описать уравнением Никольского – Эйзенманна:
E = const + S ·  ,
,
где  – потенциометрический коэффициент селективности; zB – заряд постороннего иона В.
– потенциометрический коэффициент селективности; zB – заряд постороннего иона В.
Потенциометрический коэффициент селективности характеризует селективность ион-селективного электрода к иону В по сравнению с основ-ным ионом А.
Мембранный потенциал возникает из-за наличия скачка потенциалов на границе фаз «исследуемый раствор – мембрана» и «мембрана – внут-ренний раствор». Механизм возникновения скачков потенциала различен для разных мембран.
Стеклянный электрод. Механизм отклика описывается моделью мембраны с фиксированным зарядом. Стеклянная мембрана совершенно не проницаема для ионов. В решетке диоксида кремния (основа мембраны) имеются сильноосновные группы, обладающие сродством к ионам водоро-да. Фактически поверхность стекла является ионообменником:
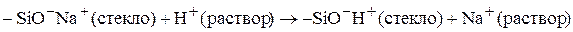
В результате сорбции ионов водорода возникает разделение зарядов и межфазный скачок потенциала на каждой стороне мембраны. Ток через мембрану переносят ионы натрия, продвигаясь только на несколько атом-ных диаметров и передавая энергию следующему иону. Между ионами водорода во внутреннем и исследуемом растворах достигается равновесие, в результате которого устанавливается потенциал
 ,
,
где K – постоянная, включающая разность потенциалов внутреннего и внешнего электродов сравнения, потенциал жидкостного соединения и потенциал асимметрии (возникает за счет механических напряжений в стекле). Поскольку для каждого электрода рН внутреннего раствора постоянен, уравнение преобразуется к виду
E = K’ + 0,059pH.
В практической работе величина K’ учитывается на стадии калибровки.
Электроды с твердыми мембранами. Их можно изготовить из кристаллических материалов в виде пластинок или таблеток. Такие материалы обладают ионной проводимостью и умеренной растворимостью в воде. Чаще всего используют AgCl, Ag2S, LaF3, Ag2S + CuS, Ag2S + CdS, Ag2S + PbS. Электрический ток в кристаллической мембране переносят ионы кристаллической решетки с наименьшим радиусом и зарядом. Например, в кристалле фторида лантана проводящим ионом является F–. Движение ионов связано с наличием дефектов решетки; в соответствии с этим механизмом ближайший к вакантному месту ион перемещается на него. Требования к дефектам таковы, что подвижный ион кристаллической решетки является единственным, способным перейти на это место. Таким образом, селективность мембраны связана с ограниченным движением всех ионов, кроме определяемого.
Электроды с жидкими мембранами. Мембраны изготовлены из тонкого пористого органического полимера, который насыщен раствором жидкого ионообменника (нейтральный или отрицательно заряженный переносчик ионов) в органическом растворителе, не смешивающемся с водой. Определяемый ион входит в состав комплекса с ионообменником. Если исследуемый раствор имеет более низкую концентрацию ионов, они должны мигрировать от поверхности мембраны в исследуемый раствор. Поскольку миграция затруднена из-за большого размера органического аниона комплекса и сильной сольватации его органическим растворителем, граница раздела двух жидкостей окажется положительно заряженной. Так возникает потенциал жидкостного соединения. Широко распространены электроды для определения активности ионов кальция и нитрата. Активным компонентом мембраны нитрат-селективного электрода является раствор нитрата трис-(4,7-дифенил-1,10-фенантролината) никеля (II) в п-нитроцимоле, а для кальциевого – додецилфосфат кальция, растворенный в диоктилфенилфосфате.
Электроды с гетерогенными мембранами. В таких электродах твердое соединение, обладающее ионообменными свойствами, закрепляет-ся в полимерной матрице мембраны. Электрод состоит из ион-селективного электрода (например, стеклянного), покрытого модифицирующим мембранным слоем, который ведет себя как дополнительная селективная граница раздела. Таким образом удалось создать фермент-субстратные электроды (биосенсоры), позволяющие определять концентрацию ферментов или ферментных субстратов.
Последнее изменение этой страницы: 2016-07-23
lectmania.ru. Все права принадлежат авторам данных материалов. В случае нарушения авторского права напишите нам сюда...