
Главная Случайная страница
Категории:
ДомЗдоровьеЗоологияРнформатикаРскусствоРскусствоКомпьютерыКулинарияМаркетингМатематикаМедицинаМенеджментОбразованиеПедагогикаПитомцыПрограммированиеПроизводствоПромышленностьПсихологияРазноеРелигияСоциологияСпортСтатистикаТранспортФизикаФилософияФинансыХимияХоббиРкологияРРєРѕРЅРѕРјРёРєР°Рлектроника
Определение концентрации хлороводородной и борной кислот методом потенциометрического титрования (работа № 14)
Цель работы: определение количества НCl и H3BO3 в растворе при совместном присутствии методом кислотно-основного потенциометричес-кого титрования.
Сущность метода. Дифференциальное определение НCl и H3BO3 (в присутствии маннита или глицерина) основано на потенциометрическом титровании их 0,1 н. раствором щелочи до достижения pH раствора, отве-чающих конечным точкам титрования хлороводородной и борной кислот. Титрование проводят со стеклянным индикаторным электродом и насыщенным хлоридсеребряным электродом сравнения.
Константа диссоциации Р±РѕСЂРЅРѕР№ кислоты настолько мала (KРґРёСЃСЃ = 10–9), что сильная кислота РІ ее присутствии практически без осложнения может быть количественно оттитрована щелочью. РџРѕ завершении титрования HCl титруют Р±РѕСЂРЅСѓСЋ кислоту РІ присутствии глицерина (или маннита), СЃ которым борная кислота образует комплексную РѕРґРЅРѕРѕСЃРЅРѕРІРЅСѓСЋ кислоту, имеющую Р±óльшую константу диссоциации (KРґРёСЃСЃ = 10–5). Таким образом, РїСЂРё последовательном титровании смеси кислот РЅР° РєСЂРёРІРѕР№ титрования наблюдается РґРІРµ точки эквивалентности: первая для соляной кислоты, Р° вторая для Р±РѕСЂРЅРѕР№.
Оборудование: 1) рН-метр (порядок работы приведен в инструкции к прибору); 2) магнитная мешалка со штативом, на котором закреплены три бюретки (для растворов HCl, H3BO3 и NaOH); 3) ячейка (стакан на 150 см3); 4) стеклянный и хлоридсеребряный электроды; 5) кристаллизатор для промывания электродов; 6) цилиндры на 100см3 для воды и на 10 см3 для глицерина; 7) стакан для слива; 8) промывалка; 9) фильтровальная бумага.
Реактивы: 1) 0,1 н. раствор H3BO3 (6,1844 г/дм3, взвешивать на аналитических весах); 2) 0,1 н. раствор НCl (приготовленный из стандарт-титра); 3) 0,1 н. раствор NaOH (4,0 г/дм3, взвешивать на технических весах); 4) 0,5 н. раствор NaOH (20,0 г/дм3, взвешивать на технических весах); 5) глицерин.
Ход работы. Стандартизация раствора гидроксида натрия мето-дом потенциометрического титрования. Готовят ~ 0,1 н. раствор щелочи, определяют его концентрацию с точностью до четвертого знака после запятой.
Пипеткой отбирают 10,00 см3 0,1 н. раствора HCl и приливают в ячейку для титрования. Помещают в нее электроды, добавляют дистилли-рованную воду так, чтобы покрыть электроды (~40 см3), включают рН-метр и записывают показания прибора до начала титрования.
Заполняют бюретку приготовленным раствором NaOH и начинают титрование, приливая раствор NaOH порциями по 1,00 см3. Замеряют pH в каждой точке титрования, результаты записывают в таблицу (табл. 2.3). При добавлении некоторого количества титранта наблюдается резкий скачок величины рН (скачок титрования). Титрование продолжают до тех пор, пока рН раствора станет изменяться на 0,1 – 0,2 единицы рН при при-бавлении 1 см3 титранта (как правило, 5 – 6 см3 после скачка титрования).
Таблица 2.3
Кривая титрования раствора NaOH стандартным раствором HCl (V(HCl) = 10,00 см3; Сн(HCl) = 0,1000 моль/дм3)
| V(NaOH) | pH | DV | DpH | DpH/DV |
| … | … | … | … | … |
По данным табл. 2.3 построить график зависимости «рН – объем титранта» (рис. 2.6). Для нахождения точки эквивалентности можно пользоваться несколькими способами (приложение 2): графическим, методом Грана, методом графического дифференцирования.
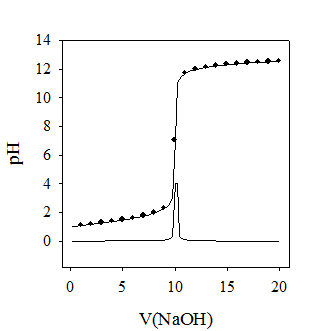
Рис. 2.6. Кривая потенциометрического титрования
хлороводородной кислоты гидроксидом натрия
РћРґРЅРёРј РёР· перечисленных методов определить точку эквивалент-ности Рё эквивалентный объем титранта VСЌРєРІ. Титрование повторяют РґРѕ получения трех сходящихся результатов, РїСЂРё этом для каждого титрования строят СЃРІРѕР№ график. РР· трех определений находят средний объем 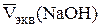 Рё рассчитывают концентрацию раствора NaOH СЃ точностью РґРѕ четырех значащих цифр:
и рассчитывают концентрацию раствора NaOH с точностью до четырех значащих цифр:
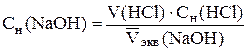 .
.
Определение концентрации борной кислоты. В ячейку наливают 10,00 см3 исследуемого раствора H3BO3, доливают 40 см3 дистиллирован-ной воды, погружают промытые электроды и мешалку, затем при хорошем перемешивании измеряют начальное значение pH раствора (pH1). Приливают 5 см3 глицерина и титруют, приливая по 0,5 см3 титранта до pH 11 – 11,3. Повторяют титрование для получения трех параллельных результатов, которые заносят в таблицу, аналогичную табл. 2.3. Строят кривые титрования и определяют эквивалентный объем NaOH 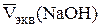 , рассчитывают средний объем из трех параллельных результатов и определяют концентрацию борной кислоты с точностью до четырех значащих цифр:
, рассчитывают средний объем из трех параллельных результатов и определяют концентрацию борной кислоты с точностью до четырех значащих цифр:
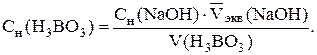
Учебная задача. Готовят смесь хлороводородной и борной кислот (по 10,00 см3 той и другой). Титруют ее порциями раствора NaOH по 0,5 см3 до завершения первого скачка титрования рН @ 9,0 – 9,3, соответ-ствующего взаимодействию NaOH с HCl. Добавляют 5 см3 глицерина и продолжают титрование до pH 11 – 11,3. При этом оттитровывается комплекс борной кислоты с глицерином (рис. 2.7).
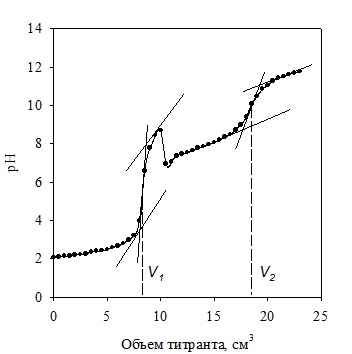
Рис. 2.7. Кривая потенциометрического титрования смеси хлороводородной и борной кислот раствором гидроксида натрия
Результаты заносят в таблицу, аналогичную табл. 2.3. Строят кривые титрования и определяют эквивалентные объемы NaOH для хлороводород-ной и борной кислот: V1(NaOH) = V1; V2(NaOH) = V2 – V1.
По трем параллельным результатам рассчитывают исходные объемы соляной и борной кислот с точностью до четырех значащих цифр:
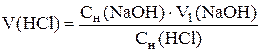
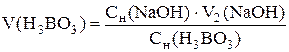
Контрольная задача. Получают контрольную задачу и путем титрования определяют объемы кислот известной концентрации.
Задание
1. Построить кривые титрования, найти точки эквивалентности, определить эквивалентные объемы для каждого титрования (см. приложение 3).
2. Рассчитать концентрацию раствора гидроксида натрия.
3. Рассчитать концентрацию раствора борной кислоты.
4. РСЃС…РѕРґСЏ РёР· заданного объема кислот Рё результата определения рассчитать относительную ошибку метода.
5. Рассчитать объемы растворов соляной и борной кислот, содержа-щихся в контрольной задаче.
6. При наличии измерений в серии параллельных опытов провести статистическую обработку результатов анализа: рассчитать среднее арифметическое значение, среднеквадратичную ошибку, доверительный интервал, относительную ошибку определения (см. приложение 2).
Контрольные вопросы
1. Сущность метода.
2. Какой раствор в данном методе является стандартным? Как он го-товится? На каких весах берется навеска NaOH? Какая мерная посуда используется?
3. Какая реакция лежит в основе данного метода? К какому типу она относится?
4. Как подсчитать молярную массу эквивалентов NaOH и H3BO3 в данном методе?
5. Как теоретически построить кривую титрования сильной (слабой) кислоты сильным основанием?
6. Как графически найти точки эквивалентности?
7. Почему кислоты титруются отдельно?
8. Почему борная кислота в присутствии хлороводородной практи-чески не диссоциирует?
9. Для чего добавляется глицерин? Напишите уравнение реакции.
10. Какие электроды используются? РС… устройство.
11. В чем преимущество потенциометрического метода определения точки эквивалентности перед индикаторным?
12. Как рассчитать массу HCl и H3BO3 в задаче?
13. Всегда ли воспроизводимые результаты правильны?
Последнее изменение этой страницы: 2016-07-23
lectmania.ru. Все права принадлежат авторам данных материалов. В случае нарушения авторского права напишите нам сюда...