
Категории:
ДомЗдоровьеЗоологияИнформатикаИскусствоИскусствоКомпьютерыКулинарияМаркетингМатематикаМедицинаМенеджментОбразованиеПедагогикаПитомцыПрограммированиеПроизводствоПромышленностьПсихологияРазноеРелигияСоциологияСпортСтатистикаТранспортФизикаФилософияФинансыХимияХоббиЭкологияЭкономикаЭлектроника
Постояннотоковая (классическая) полярография
Постояннотоковая полярограмма – зависимость тока на ртутном капающем электроде (РКЭ) при линейной развертке потенциала.
Ртутный капающий электрод является катодом. Для приложенного к ячейке потенциала можно записать
Eприл = E + i · R = Еравн + η + i · R,
где i × R – омическое падение потенциала, требуемое для протекания тока через ячейку; Еравн – потенциал при разомкнутой цепи, т.е. равновесный потенциал; η – перенапряжение.
Величина омического падения потенциала i · R при микроамперных токах i существенна, только если сопротивление раствора R велико. Сопротивление R снижают добавлением в раствор инертного (фонового) электролита.
Перенапряжение η является мерой энергии активации гетерогенной химической реакции (реакции переноса заряда) и необходимо для преодоления активационного барьера реакции. Величина перенапряжения электродной реакции зависит от материала электрода.
На рис. 2.20 показана линейная развертка напряжения Е = E0 + vt, где E0 – начальный потенциал, a v – скорость поляризации (развертки).
Ток измеряют непрерывно в течение времени жизни каждой капли (рис. 2.21). Получаемые кривые зависимости тока от потенциала (поляро-граммы) используют для анализа (рис. 2.22).
Массоперенос растворенного вещества к электроду осуществляется за счет диффузии, механической конвекции и электростатического притяжения. Для полярографического анализа важно устранить две последние причины, чтобы массоперенос определяемого вещества к поверхности электрода осуществлялся только в результате диффузии.
Электростатическое притяжение ионов определяемого вещества электродом (миграционный ток) становится пренебрежимо малым в присутствии фонового электролита с концентрацией в 50 – 100 раз выше концентрации определяемого вещества, например 1М НСl.
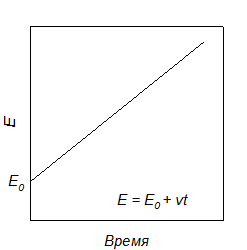
Рис. 2.20. Линейная развертка потенциала
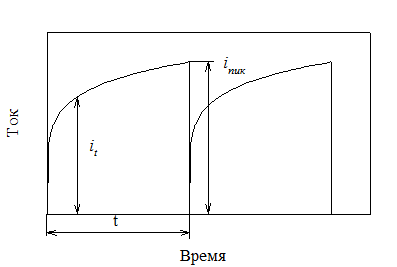
Рис. 2.21. Кривые «ток – время» для ртутного капающего электрода
Полярограммы (зависимости i от Е). Зависимость тока от потенциала в условиях диффузионного массопереноса называется полярограммой. На рис. 2.22 приведена полярограмма, снятая в неперемешиваемом растворе, содержащем 5×10–3 М Cd2+ и 0,1 М НСl, из которого удален кислород.
Восстановление Cd2+ на капающем ртутном катоде вызывает ступенчатый рост тока:
Cd2+ + 2е– = Cd(Hg)
Полярограмма состоит из трех участков. Первый соответствует остаточному току при небольших отрицательных потенциалах электрода (рис. 2.22, участок А). Второй (участок В) отвечает току, контролируемому переносом заряда, при значениях электродного потенциала, соответствующих или превышающих потенциал восстановления Cd2+. На этом участке с увеличением потенциала ток растет экспоненциально. Скорость реакции контролируется ее кинетикой, и стационарный ток обеспечивается диффузией. Участок С соответствует предельному току, контролируемому скоростью диффузии.
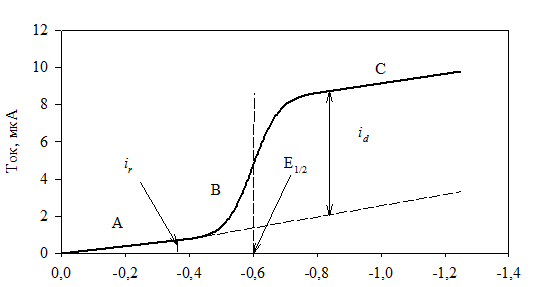
Потенциал (относительно н.к.э.), В
Рис. 2.22. Постояннотоковая полярограмма
и ее важнейшие характеристики: id – сила предельного тока;
Е½ – потенциал полуволны
Остаточный ток (ir). Остаточный ток состоит из фарадеевского тока и тока заряжения (емкостного тока). Фарадеевская компонента остаточного тока обусловлена электрохимическим восстановлением или окислением примесей из фонового электролита. Концентрация фонового электролита относительно высока по сравнению с концентрацией опреде-ляемого вещества, поэтому вклад примесей в измеряемый остаточный ток может быть значительным.
Емкостный ток – это ток, требуемый на заряжение или разряд двойного электрического слоя (являющегося конденсатором), формиру-емого на границе раздела «индикаторный электрод – электролит». Нулевое значение тока наблюдается при –0,4 В и совпадает с электрокапиллярным максимумом, при котором поверхность ртутной капли не заряжена. Каждая капля заряжается или разряжается, и емкостный ток при регистрации полярограммы протекает постоянно. Его величина ic зависит от потенциала и площади поверхности электрода:
ic = k · Ci · 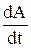 ·(Еприл – Ez),
·(Еприл – Ez),
где Сi – интегральная емкость двойного слоя; А – площадь поверхности электрода; t – время жизни капли, с; Еz – потенциал нулевого заряда (потенциал электрокапиллярного максимума); k – коэффициент пропор-циональности.
Для капающего ртутного электрода
А = 0,85 · m2/3 · t2/3,
где m – скорость вытекания ртути из капилляра, мг/с.
Поэтому
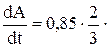 m2/3 · t –1/3 = 0,57 · m2/3 · t –1/3.
m2/3 · t –1/3 = 0,57 · m2/3 · t –1/3.
Следовательно,
ic = k’ · Ci · m2/3 · t –1/3 · (Еприл – Ez).
Ток, контролируемый переносом заряда (фарадеевский ток). Рассмот-рим процесс восстановления на ртутном капающем электроде:
Ox + ne– 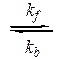 Red,
Red,
где kf – константа скорости прямой реакции; kb – константа скорости обратной реакции.
Если Eприл < Еравн, т.е. Еприл отрицательнее равновесного потенциала (измеренного при i = 0), через ячейку протекает стационарный ток, величина которого зависит от скоростей таких процессов, как перенос электронов на электроде и массоперенос окисленной формы из объема раствора к поверхности электрода, и устанавливается новое равновесие.
Eприл = E0 + 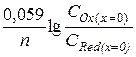 ,
,
где СOx и СRed – концентрации соответственно окисленной и восстанов-ленной форм у поверхности электрода (х = 0).
Величина суммарного тока определяется уравнением
i = nFA(kf COx – kbCRed),
где А – площадь поверхности электрода.
Константы скорости реакции переноса заряда зависят от Еприл:
kf =  exp
exp 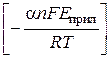 ,
,
kb = 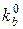 exp
exp  ,
,
где k0 – константа скорости, измеренная при Еприл = 0, т.е. константа ско-рости соответствующей химической реакции; α – множитель, отвечающий доле электродного потенциала, дающего вклад в соответствующую хими-ческую реакцию.
Уравнения показывают, что электродный потенциал влияет на константы скорости, поскольку изменяется энергия активации. Например, смещение потенциала катода к более отрицательным значениям облегчает процесс восстановления, поскольку потенциальная энергия увеличивается на величину αnFE, что проявляется в снижении энергии активации. В то же время для анодной реакции подобное уменьшение потенциала приводит к снижению скорости.
Соответственно
i = nFA  СRed
СRed 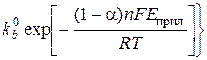 .
.
Это уравнение получило название уравнения Фольмера – Батлера. Из него следует, что ток в данной области изменяется экспоненциально с изменением Еприл из-за того, что скорость электродной реакции меньше скорости диффузии определяемого вещества.
Предельный ток. Скорость электродной реакции зависит от Еприл по уравнению Фольмера – Батлера, обсужденному выше. Для случая, когда перенос заряда и сопряженные химические реакции протекают очень быстро, скорость электродной реакции v контролируется скоростью массо-переноса (vмп):
v = vмп = 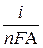 .
.
Полярограммы регистрируют в неперемешиваемых растворах в присутствии фонового электролита с концентрацией в 50 – 100 раз выше концентрации определяемого вещества, поэтому возникающий при электролизе градиент концентрации контролирует скорость диффузии определяемого вещества к электроду:
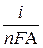 = m0 · (COx – COx (x = 0)),
= m0 · (COx – COx (x = 0)),
где COx – концентрация окисленной формы Ох в объеме раствора; COx (x = 0) – ее концентрация на поверхности электрода; m0 – число переноса.
Значение COx (x = 0) зависит от потенциала электрода. Наибольшая ско-рость массопереноса – при COx (x = 0) = 0. Ток достигает максимального зна-чения, когда скорость диффузии окисленной формы становится постоян-ной; его называют предельным диффузионным током id (см. рис. 2.22, участок С).
Полагая, что диффузия к поверхности растущей капли ртути происходит так же, как и к плоскому электроду, и решая уравнения диффузионной кинетики с привлечением первого и второго законов Фика, Илькович вывел уравнение, описывающее зависимость величины предельного диффузионного тока id (мкА) от концентрации электродно-активного вещества СOx в объеме раствора (моль/дм3):
id = 607 · n · D 1/2 · m 2/3 · t 1/6 · COx,
где n – число электронов; D – коэффициент диффузии, см2/c ; m – скорость вытекания ртути из капилляра, мг/с; t – время жизни капли (период капания), с.
Среди факторов, влияющих на величину диффузионного тока, наиболее важным является концентрация определяемого вещества: диффузионный ток id пропорционален концентрации определяемого вещества в растворе СOx. Эта строгая зависимость, описываемая уравнени-ем Ильковича, – основа количественного полярографического анализа.
При определении id следует помнить: a) id = it – ir (значение оста-точного тока ir следует всегда вычитать из значения предельного тока it); б) метод измерения id должен быть одним и тем же на протяжении всей серии опытов. Поправку на остаточный ток ir можно сделать или экстра-поляцией его значения на потенциал, при котором графически определя-ется id, или измерением в чистом фоновом электролите.
С повышением температуры на 1 оС диффузионный ток увеличива-ется примерно на 2%, поскольку рост температуры вызывает увеличение коэффициента диффузии D. Таким образом, изменение температуры в ходе опыта может существенно повлиять на результаты анализа. Изучение влияния температуры на величину предельного диффузионного тока показало, что для определения id с погрешностью, меньшей 1%, темпера-туру электрохимической ячейки следует поддерживать в пределах ±0,5 °С.
Потенциал полуволны E½. Для обратимой электродной реакции в ин-тервале потенциалов, соответствующих i > 0 и i < id, зависимость соотно-шения концентраций окисленной формы COx (x = 0) и восстановленной фор-мы CRed (x = 0) от потенциала электрода можно описать уравнением Нернста:
Eприл = E0 + 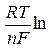
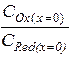 . (2.10)
. (2.10)
В результате протекания процесса
Ox + ne– = Red
сила тока в цепи возрастает и концентрация восстанавливающихся частиц Ox у поверхности ртутной капли уменьшается. Подвод электроактивных частиц к электроду обеспечивает диффузия, скорость которой пропорцио-нальна разности концентраций в массе раствора COx и в приэлектродном слое COx (x=0). Сила тока i будет пропорциональна этой разности:
i = k · DOx ½ · (COx – COx (x = 0)),
где k = 607 · n · m 2/3 · t 1/6.
Поскольку в соответствии с уравнением Ильковича id = k · DOx ½ · COx, то
i = id – k · DOx ½ · COx (x = 0),
откуда
id – i = k · DOx ½ · COx (x = 0). (2.11)
Величину i можно связать с массопереносом не только реагирую-щего вещества Ox к поверхности ртутной капли, но и продукта реакции Red от нее. При этом если CRed = 0, то
i = k · DRed ½ · CRed (x = 0). (2.12)
Из уравнений (2.11) и (2.12) получается выражение для отношения концентраций веществ Ох и Red в приэлектродном слое:
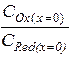 =
=  . (2.13)
. (2.13)
Подстановка выражения (2.13) в уравнение (2.10) дает
Eприл = E½ + 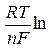
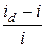 , (2.14)
, (2.14)
где E½ = E0 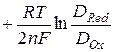 – потенциал полуволны, определяемый приро-дой окислительно-восстановительной системы. Если DRed ≈ DOx, то E½ ≈ E0, т.е. потенциал полуволны практически равен стандартному электродному потенциалу соответствующей полуреакции. Следует заметить, что E½ ¹ E0, если продукт электродной полуреакции образует с ртутью амальгаму.
– потенциал полуволны, определяемый приро-дой окислительно-восстановительной системы. Если DRed ≈ DOx, то E½ ≈ E0, т.е. потенциал полуволны практически равен стандартному электродному потенциалу соответствующей полуреакции. Следует заметить, что E½ ¹ E0, если продукт электродной полуреакции образует с ртутью амальгаму.
Выражение для Еприл в форме (2.14) или вида
Eприл = E½ + 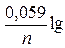
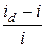
называют уравнением обратимой катодной полярографической волны.
Поскольку потенциал полуволны не зависит от концентрации опре-деляемого вещества в растворе, а зависит в первую очередь от его приро-ды, его можно использовать для идентификации вещества, участвующего в электродной полуреакции. Однако это следует делать с осторожностью, поскольку на величину E½ могут влиять различные факторы, например, рН раствора и константа равновесия гомогенной реакции в растворе.
Факторы, влияющие на форму полярограммы. При измерении диффузионного тока id необходимо учитывать, что на форму полярограм-мы влияют:
– остаточный ток;
– полярографические максимумы (максимумы тока);
– присутствие растворенного кислорода.
Полярографические максимумы различной формы появляются в области предельного тока, а также в начале плато на полярограмме. Они наблюдаются на полярограммах катионов, анионов и нейтральных моле-кул. В общем случае, их возникновение связывают с конвекцией слоя раствора у поверхности индикаторного электрода, вызванной неравномер-ным распределением заряда на поверхности ртутной капли. Максимумы можно подавить добавлением следовых количеств полярографически неактивных поверхностно-активных веществ (ПАВ), таких как желатин, метиловый красный и другие красители. Обычно к 10 мл раствора добавляют 0,1 – 0,2 мл 0,5%-ного желатина. При концентрациях выше некоторого порогового значения (>10–4 %) диффузионный ток начинает зависеть от концентрации ПАВ из-за изменения вязкости раствора.
ПАВ необходимы только в классической полярографии при работе с ртутным капающим электродом.
В растворе, контактирующем с воздухом, присутствует растворен-ный кислород, который способен восстанавливаться на ртутном капающем электроде с образованием двух волн одинаковой высоты:
О2 + 2Н+ + 2е– → Н2О2, E½ » 0,1 В (относительно н.к.э.)
Н2О2 + 2Н+ + 2е– → 2Н2О, E½ » 0,9 В (относительно н.к.э.)
Поскольку волны восстановления кислорода появляются в диапазоне 0 – 1 В, кислород мешает определению многих веществ, восстанавливаю-щихся в этом диапазоне потенциалов. Эти помехи можно устранить, удалив О2. Из растворов с любым рН кислород удаляют продуванием азота или аргона в течение 10 мин. В процессе измерений газ продолжают продувать над поверхностью раствора. Из щелочных растворов кислород удаляют с помощью сульфита натрия (к 10 мл раствора добавляют 0,2 мл насыщенного раствора Na2SO3).
Полярография как метод анализа. Многие органические и неоргани-ческие соединения полярографически активны, т.е. вступают в электро-химические реакции в интервале поляризации ртутного капающего электрода. Этот интервал ограничен значениями потенциала окисления ртути (+0,3 В относительно н.к.э.) и потенциалами восстановления раство-рителя или фонового электролита (–1,8…–2,2 В относительно н.к.э.).
Общие принципы приготовления растворов для полярографических измерений:
– раствор должен содержать полярографически неактивные фоновые электролиты, такие как соли, кислоты или буферные растворы;
– для подавления максимумов в растворе должно присутствовать некоторое количество поверхностно-активного вещества;
– предварительно необходимо удалить растворенный кислород.
Полярограммы имеют две четкие характеристики: E½ и id, которые и служат основой для полярографического анализа. Значение E½ xaрактери-зует электроактивное вещество и среду, в которой проводится анализ. Таким образом, экспериментально найденное значение E½ можно с некоторой долей осторожности на основе табулированных значений использовать для идентификации неизвестного вещества.
Полярография – метод количественного анализа, основанный на линейной зависимости id от концентрации определяемого вещества в растворе. Для определения концентрации можно использовать метод градуировочного графика или метод добавок.
В условиях, контролируемых диффузией, для определения веществ при концентрациях в диапазоне 5×10–5 – 5×10–3 моль/дм3 применима класси-ческая полярография. Предел обнаружения 1×10–5 – 5×10–5 моль/дм3 опреде-ляется значением остаточного тока.
Разрешающая способность метода зависит от разности потенциалов полуволн E½ электроактивных веществ А и В и соотношения их концентраций. Две полярографические волны разделяются, если DE½ ³ 150 – 200 мВ, а концентрации А и В примерно равны. Если же их концентрации различаются значительно, возможность одновременного определения зависит от того, является ли потенциал полуволны вещества с большей концентрацией менее или более отрицательным, чем потенциал полуволны второго определяемого вещества.
Влияние комплексообразующих веществ на потенциалы полуволн восстановления ионов металлов можно использовать для разделения перекрывающихся волн. Классическим примером является разделение полярографических волн свинца и таллия на ртутном капающем электроде. В кислых и нейтральных растворах потенциалы полуволн свинца и таллия практически одинаковы и их волны перекрываются. В то же время в щелочном растворе свинец образует гидроксокомплекс, а таллий остается в виде аквакатиона. За счет этого между потенциалами полуволн возникает разница порядка 300 мВ, что вполне достаточно для их количественного определения при примерно одинаковых концентрациях.
Измерение диффузионных токов. При измерении диффузионных токов следует учесть остаточный ток ir и вычесть его значение из предельного тока id. Для измерения id предложены различные графические методы. Все они основаны на предположении, что остаточный ток линейно растет с повышением потенциала, следовательно, его значение при любом потенциале можно учесть экстраполяцией (см. рис. 2.22). Обычно поль-зуются заранее построенным градуировочным графиком в координатах «id – концентрация ионов».
Точность полярографического анализа. Точность полярографичес-кого определения концентрации зависит в первую очередь от воспроизво-димости величины id и погрешности графического способа оценки диффу-зионного тока. Первая из них высока вследствие постоянно обновляющей-ся поверхности электрода. При контролируемых условиях эксперимента погрешность определения концентрации составляет 1 – 5 %.
Методы ступенчатого наложения потенциала. Предел обнаруже-ния в полярографии определяется величиной остаточного тока, точнее током заряжения. Различие временных характеристик емкостного тока и фарадеевского тока положено в основу новых способов снижения предела обнаружения в полярографии. Они основаны на измерении тока как функ-ции времени (хроноамперометрия) после наложения импульса потенциала. Ток измеряют не непрерывно, а в течение некоторого интервала времени.
Так называемая стробированная постояннотоковая полярография (раньше ее называли таст-полярографией) использует тот факт, что диффузионный ток id на ртутном капающем электроде за время жизни ртутной капли растет пропорционально t1/6, в то время как емкостный ток уменьшается пропорционально t –1/3. Это позволяет, измеряя ток в конце периода жизни капли, снизить предел обнаружения на один порядок из-за улучшения соотношения id / it.
Очень эффективный способ увеличения соотношения «сигнал / шум» основан на использовании стробирующей или синхронизирующей системы, позволяющей измерять ток только в конце жизни капли.
Стробирующую систему можно синхронизировать с ртутным капаю-щим электродом, либо детектируя отрыв капли с помощью электронного сенсора, либо стряхивая капли в заданный момент времени. Например, временную цепь можно сконструировать так, чтобы стряхивать капли через интервалы в три секунды, а самописец подключать только в интервале от 2,4 до 2,9 с. В течение 2,5 с, когда ток не измеряют, самописец будет просто чертить горизонтальный прямолинейный участок. Получающуюся кривую обработать для количественных расчетов гораздо легче, чем немодифицированную полярограмму.
Последнее изменение этой страницы: 2016-07-23
lectmania.ru. Все права принадлежат авторам данных материалов. В случае нарушения авторского права напишите нам сюда...