
Категории:
ДомЗдоровьеЗоологияИнформатикаИскусствоИскусствоКомпьютерыКулинарияМаркетингМатематикаМедицинаМенеджментОбразованиеПедагогикаПитомцыПрограммированиеПроизводствоПромышленностьПсихологияРазноеРелигияСоциологияСпортСтатистикаТранспортФизикаФилософияФинансыХимияХоббиЭкологияЭкономикаЭлектроника
Методы измерения электрической проводимости
Для измерения электропроводности служит модифицированный мост Уитстона (рис. 2.11).
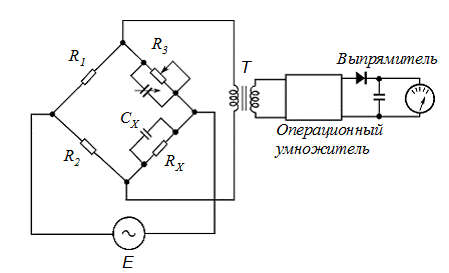
Рис. 2.11. Мост Уитстона для измерения электропроводности
Мост питается от источника переменного напряжения Е с частотой 1 кГц. Плечи R1 и R2 с помощью переключателя можно подобрать так, чтобы соотношение сопротивлений было точно известно. RX – сопро-тивление кондуктометрической ячейки, шунтированное емкостью СX. R3 – прецизионное калиброванное переменное сопротивление, шунтиро-ванное для балансировки емкости ячейки. Переменное напряжение, возникающее по диагонали моста, усиливают, выпрямляют и измеряют. При проведении измерений подбирают такое положение переключателя и величину R3, чтобы измерительное устройство показывало нулевое отклонение. В этот момент сопротивление ячейки
 ,
,
а ее электропроводность
 .
.
В современных кондуктометрах измерение электропроводности основано на использовании цепи, контролируемой операционным усилителем. Приборы не требуют балансировки, как при использовании моста, а позволяют производить непрерывное считывание.
Конструкция ячейки может быть различной, главное условие – постоянство расстояния между электродами. Электроды изготовляют из платины, покрытой губчатой платиной (платинированная платина). Важное значение имеет термостатирование раствора – при изменении температуры на 1 оС электропроводность изменяется на 1,5 – 2%. Для прямой кондуктометрии необходима калибровка ячейки по стандартным растворам.
Прямая кондуктометрия
Удельная электропроводность растворов сильных и слабых электро-литов в довольно широких пределах (до 10 – 20 масс. %) линейно зависит от концентрации (рис. 2.10). Это позволяет измерять концентрацию конкретных веществ на специально откалиброванных приборах.
Вода очень плохой проводник, при 25 оС ее удельная электропроводность kпримерно равна 5×10–8 Ом–1×см–1. Электропровод-ность дистиллированной или деминерализованной воды намного ниже. Измерение электропроводности позволяет вести непрерывный контроль за степенью чистоты воды.
Найдено, что удельная электропроводность морской воды связана с соленостью S, выражаемой в граммах на килограмм Н2О, уравнением
k = 1,82·10–3 S – 1,28·10–5 S 2 + 1,18·10–7 S 3.
Средняя величина S неразбавленной морской воды равна 35,0 г/кг. Контроль электропроводности природных вод (в том числе морских) – важная составляющая часть экологического мониторинга окружающей среды.
Кондуктометрическое титрование
Кондуктометрическое титрование возможно только в том случае, если электропроводность исходного раствора значительно отличается от электропроводности реагента или продуктов реакции. Кривая кондуктометрического титрования представляет собой зависимость электрической проводимости раствора (w = 1/R Ом–1) от объема прилитого титранта. Метод очень полезен при титровании сильно окрашенных или мутных растворов.
Характер изменения электрической проводимости при титровании обусловлен замещением одних ионов другими, имеющими другое значение подвижности. При этом кривая титрования состоит из отрезков прямых, пересечение которых позволяет найти точку эквивалентности и эквивалентный объем титранта. Для того чтобы линии были прямыми, объем титруемой жидкости должен практически не меняться; для этого титрант должен быть более концентрированным, чем исследуемый раствор. Разбавление можно учесть расчетным путем:
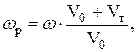
где wр – расчетное значение электропроводности с учетом разбавления, См; V0 – исходный объем раствора в ячейке для титрования, см3; Vт – объем прилитого титранта, см3.
Кислотно-основное титрование. При титровании, например, соляной кислоты раствором гидроксида натрия происходит замещение ионов водорода менее подвижными ионами натрия, так как при реакции нейтрализации образуется практически недиссоциированная вода. При продолжающейся нейтрализации электрическая проводимость раствора, содержащего кислоту, постепенно убывает, пока все ионы Н+ не будут замещены ионами Na+, т.е. пока кислота не будет нейтрализована (рис. 2.12а). При дальнейшем приливании щелочи ω снова возрастает вследствие увеличения общего числа ионов в растворе, и в особенности гидроксильных. Поскольку lОН– < lН+, то линия электрической проводи-мости до точки эквивалентности падает круче, чем поднимается после нее.
На рис. 2.12б приведена схема, отражающая качественный характер изменения концентрации ионов при титровании, полезная для уяснения кривой кондуктометрического титрования. Величина CCl– в процессе титрования практически не изменяется, тогдa как CNa+ будет монотонно возрастать. Величина CН+ будет уменьшаться от исходной величины прак-тически до нуля в точке эквивалентности, а концентрация СОН–, практичес-ки равная нулю в точке эквивалентности, после нее будет возрастать.
Таким образом, изменение электрической проводимости до точки эквивалентности определяется действием двух взаимно противоположных тенденций: понижающей за счет уменьшения СН+ и возрастающей за счет увеличения СNa+. Результирующая этих вкладов (рис. 2.12а) показывает резкое уменьшение электрической проводимости до точки эквивалент-ности. Оно обусловлено снижением концентрации иона Н+, имеющего при 25 °С подвижность 350 См×см2/моль, намного превышающую подвижность иона Na+ (50 См×см2/моль).

Рис. 2.12. Кондуктометрическое титрование сильной кислоты
сильным основанием: а – изменение электрической проводимости
(т.э. – точка эквивалентности); б – изменение концентрации ионов
При титровании слабой кислоты сильным основанием (рис. 2.13а) w раствора растет вследствие замещения слабо диссоциированной кислоты солью (участок аb). После точки эквивалентности w растет еще быстрее, так как в растворе появляется избыток гидроксильных ионов (участок bс).
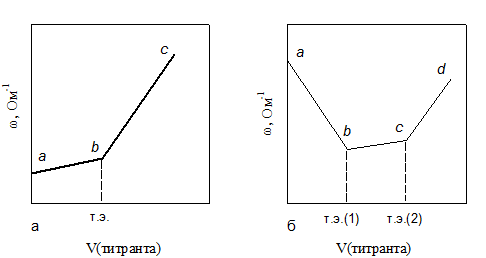
Рис. 2.13. Кондуктометрическое титрование сильным основанием:
а – слабой кислоты; б – смеси сильной и слабой кислот
При титровании смеси сильной и слабой кислот (рис. 2.13б) в реак-цию с основанием в первую очередь вступает сильная кислота и только после ее нейтрализации – слабая. Нейтрализация сильной кислоты вызывает падение w (участок аb). После первой точки эквивалентности начинается титрование слабой кислоты (участок bс) с увеличением w вследствие образования хорошо диссоциированной соли. После второй точки эквивалентности наблюдается увеличение w (участок сd), обусловленное появлением избытка гидроксид-ионов. Таким образом, b и c – это точки эквивалентности при титровании смеси кислот.
Осадительное титрование. Вид кривой титрования зависит от подвижности ионов реагентов (определяемого вещества и осадителя), их концентрации и от величины ПР. Например, при титровании 0,001 М растворов ПР осадка должно быть не более 10–9. Ход кривой титрования можно предсказать, построив диаграмму, подобную рис. 2.12б.
Комплексонометрическое титрование. Прямое титрование ЭДТА возможно в растворах, содержащих буфер, и в растворах, не обладающих буферными свойствами. Форма кривых сильно зависит от условий титрования.
В слабокислых растворах, не содержащих буферных смесей, кривые до точки эквивалентности довольно круто поднимаются вверх вследствие накопления в растворе весьма подвижных Н+-ионов. Участок кривой после точки эквивалентности имеет очень малый наклон, или совсем горизонтален, или даже немного наклонен вниз. Величина наклона в этом случае зависит от рН раствора и связана с буферным действием растворов титрантов. Хорошие результаты получаются только для сильно разбавленных растворов.
В растворах, содержащих аммиачную буферную смесь, кривые титрования вначале поднимаются медленно, но после точки эквивалент-ности сразу становятся крутыми, что обусловлено появлением в растворе подвижных продуктов диссоциации титранта. Наиболее удобно применение боратного буфера. В этом случае выделяющиеся при титровании ионы водорода связываются и кривые сначала идут горизонтально, а после точки эквивалентности резко поднимаются вверх.
Титрование растворов солей ряда металлов (кальция, стронция, бария, магния, цинка, кадмия, меди, никеля, кобальта и марганца) проводят в различных условиях, но их кривые титрования почти одинаковы. Титрование кальция и магния в боратном буферном растворе используют для определения общей жесткости воды. Метод имеет особое преимущество в тех случаях, когда в растворе присутствуют окислители (например, гипохлорит-ионы), разрушающие индикаторы (например, эриохром черный Т), применяющиеся при визуальной индикации конечной точки титрования.
Последнее изменение этой страницы: 2016-07-23
lectmania.ru. Все права принадлежат авторам данных материалов. В случае нарушения авторского права напишите нам сюда...