
Категории:
ДомЗдоровьеЗоологияИнформатикаИскусствоИскусствоКомпьютерыКулинарияМаркетингМатематикаМедицинаМенеджментОбразованиеПедагогикаПитомцыПрограммированиеПроизводствоПромышленностьПсихологияРазноеРелигияСоциологияСпортСтатистикаТранспортФизикаФилософияФинансыХимияХоббиЭкологияЭкономикаЭлектроника
Рівняння стану сумішей ідеальних газів (стор. 19-27)(самостійно)
Гази, які знаходяться в одному об’ємі і які не вступають в хімічну реакцію, мають назву суміші газів.
Згідно з законом Дальтона, тиск суміші дорівнює сумі парціальних тисків газів, що в неї входять:
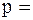
 +
+ 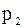 +...+
+...+ 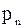 ,
,
р – тиск суміші;
 ,
, 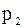 ,...,
,..., 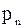 – парціальний тиск компоне-нтів.
– парціальний тиск компоне-нтів.
За законом Амага об’єм суміші ідеаль-них газів v дорівнює сумі парціальних об’є-мів 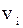 окремих компонентів:
окремих компонентів:

 +
+ 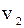 +
+ 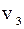 +…+
+…+  = ∑
= ∑ 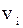
Парціальним об’ємомкомпонента сумі-ші газів називається об’єм, який би займав цей компонент при тиску і температурі су-міші. Рівняння стану для кожного компо-нента:
 ;
;
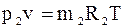 ;
;
………
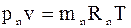 .
.
Тобто, 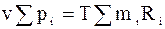 .
.
Оскільки 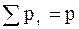 , то
, то 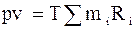 ,
,
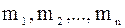 – маса даного компонента в суміші газів;
– маса даного компонента в суміші газів;
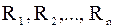 – газова стала даного компо-нента.
– газова стала даного компо-нента.
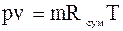
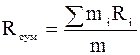
Кількісне співвідношення окремих га-зів, які входять до суміші, може бути зада-но масовими, об’ємними і мольними част-ками. Масова частка–це відношення ма-си 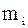 компонента до маси m газової суміші. Позначається
компонента до маси m газової суміші. Позначається 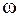 .
.


 +
+ 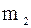 +…+
+…+ 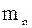 =
= 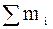
Отже, 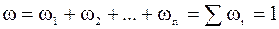
Об’ємною часткою називається відно-шення парціального об’єму компонента 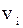 до об’єму
до об’єму 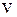 газової суміші і позначається
газової суміші і позначається  .
.
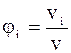
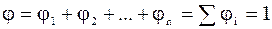
Оскільки 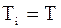 , то
, то  , тому
, тому
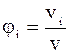 .
.
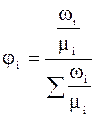
Мольна частка – це відношення числа молей даного газу 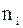 до числа молей сумі-ші газів n; позначається
до числа молей сумі-ші газів n; позначається 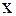 .
.

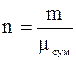
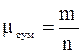
Величина 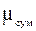 називається середньою уя-вною молекулярною масою газової сумішіі дорівнює дійсній молекулярній масі деяко-го однорідного газу, який, також як і суміш, при однаковій загальній масі m має одне і те ж саме число молей n.
називається середньою уя-вною молекулярною масою газової сумішіі дорівнює дійсній молекулярній масі деяко-го однорідного газу, який, також як і суміш, при однаковій загальній масі m має одне і те ж саме число молей n.
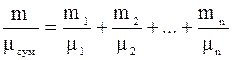
Поділимо ліву і праву частину рівності на m. З отриманого рівняння виразимо 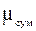 .
.
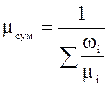
знайдемо залежності  та
та  .
.
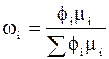
 ;
; 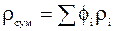 ;
;
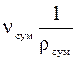 ;
; 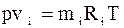 ;
;
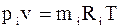 ;
;
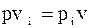 ;
;  ;
; 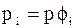 ;
;
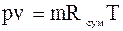 (1)
(1)
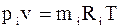 (2)
(2)
Поділимо друге рівняння на перше:
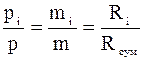 ;
; 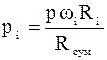 ;
;
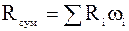 .
.
Також є справедливою формула:
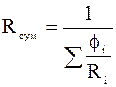 .
.
Всі наведені співвідношення справедливі для газової суміші, якщо її розглядати як ідеальний газ.
Лекція 3. (стор. 36-47)
Теплоємність
Теплоємністюназивається похідна від кількості теплоти по температурі, під час якої підводиться теплота.
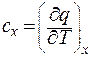 ;
;
х – означає умови, під час яких підво-диться теплота. Вимірюється в  .
.
Питомоюназивають теплоємність,яка віднесена до одної кількісної одиниці речовини. Коли за кількісну одиницю приймають 1 кг, тоді теплоємність називають масова питома теплоємність.
1 кг – с 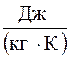 -масова,
-масова,
1 м3 – с´ 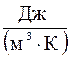 -обємна,
-обємна,
1 кмоль – μс 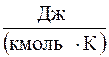 - мольна..
- мольна..
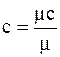 ;
;
 ,
,
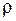 –щільність речовини.
–щільність речовини.
Для реального газу теплоємність є фун-кція тиску і температури. Для ідеального газу теплоємність залежить тільки від тем-ператури. Ця залежність може бути:
1)Криволінійною: 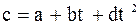
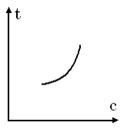
2) Прямолінійною: 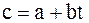
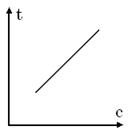
3) не залежить від температури: 

Теплоємність визначається за таблицями, до 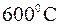 можна вважати, що вона не залежить від температури.
можна вважати, що вона не залежить від температури.
Розглядають теплоємність середню та істинну.
Середньоюназивають таку умовну теп-лоємність, під час якої робоче тіло в межах даних температур поглинає таку ж кількість теплоти, яку воно поглинає під час змінної теплоємності в межах тих же температур.

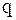 – кількість теплоти, яка підведена в межах даних температур;
– кількість теплоти, яка підведена в межах даних температур;
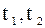 – межі температур робочого тіла.
– межі температур робочого тіла.
Істинною теплоємністюназивається границя, до якої прямує середня тепломність під час прямування різниці температур до нуля.
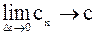
1) під час криволінійної залежності від температури теплоємність визначається як:
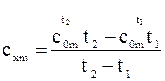
2) під час прямолінійної:

Теплоємність робочого тіла залежить від умов, під час яких підводиться теплота. Розглядають теплоємність під час  та під час
та під час 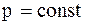 .
.
Роберт Майєр показав, що:
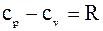
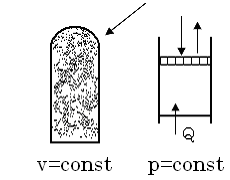
Якщо ми вважаємо, що теплоємність не залежить від температури, то її знаходять через мольну теплоємність.
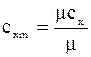
 Мольна теплоємністьзалежить від атомності газу.
Мольна теплоємністьзалежить від атомності газу.
| Тип газу | 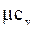
| 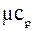
|
| кДж/К | кмоль/К | |
| 1-атомний | 12,5 | 20,8 |
| 2-атомний | 20,8 | 29,1 |
| 3-атомний | 29,1 | 37,4 |
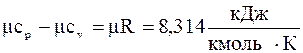
Внутрішня енергія (стор. 28-31)
Внутрішньою енергією називається сума кінетичної і потенціальної енергії молекул газу.
u – 1 кг, Дж/кг
U – m кг, Дж
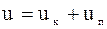
Кінетична енергія молекул визначається швидкістю руху молекул, поступального і обертального. Потенціальна енергія виз-начається силами щеплення між молеку-лами, а також розташуванням молекул у просторі. Тому для ідеального газу
 ,
, 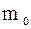 –маса 1 молекули;
–маса 1 молекули;
 –середня швидкість руху молекул.
–середня швидкість руху молекул.
Для реального газу 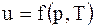 .
.
Джоуль, вивчаючи властивості газопо-дібних речовин, показав, що для ідеального газу 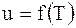 і тому
і тому
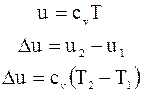 (1)
(1)
Внутрішня енергія є параметр стану, їй притаманні всі властивості параметрів ста-ну.
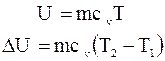
Для реального газу
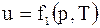

Последнее изменение этой страницы: 2016-07-23
lectmania.ru. Все права принадлежат авторам данных материалов. В случае нарушения авторского права напишите нам сюда...