
Категории:
ДомЗдоровьеЗоологияИнформатикаИскусствоИскусствоКомпьютерыКулинарияМаркетингМатематикаМедицинаМенеджментОбразованиеПедагогикаПитомцыПрограммированиеПроизводствоПромышленностьПсихологияРазноеРелигияСоциологияСпортСтатистикаТранспортФизикаФилософияФинансыХимияХоббиЭкологияЭкономикаЭлектроника
Дослідження енергетичної ефективності термодинамічних процесів ідеальних газів
(стор. 106-143)
Характеристики термодинамічного процесу
Зміна параметрів стану не залежить від шляху, за яким термодинамічна систе-ма змінює свій стан. Характеристиками процесу називаються такі величини, зміна яких залежить від характеру, шляху, за яким змінює свій стан система. Їх є чотири:
1. Робота
Розглянемо pv-діаграму.
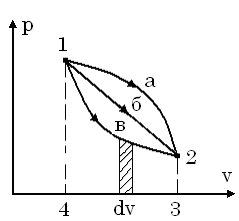

В ній є дві точки, 1 і 2, які характеризу-ють початковий і кінцевий стан системи. Між двома точками можна провести необ-межену кількість кривих ліній, тобто, тер-модинамічних процесів. Таким чином, мо-жна провести 1а, 1б, 1в і так далі. Ми знає-мо, що в pv-діаграмі площа під кривою про-цесу являє собою в деякому масштабі робо-ту. Робота залежить від характеру процесу. Так як з математики відомо, що якщо зна-чення підінтегральної функції залежить від шляху інтегрування, то підінтегральна функція  є неповний диференціал.
є неповний диференціал.

2. Теплота
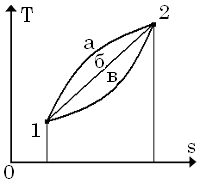
В Ts-діаграмі площа під кривою про-цесу є теплота.

 є також неповний диференціал.
є також неповний диференціал.
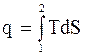
3. Коефіцієнт використання термоди-намічного потенціалу (КВП)
В загальному вигляді термодинаміч-ний потенціал позначається літерою А для маси m кг. КВП позначається літерою  , де Х характеризує характер процесу. КВП являє собою відношення зміни термодина-мічного потенціалу в процесі до його значе-ння в початковому стані.
, де Х характеризує характер процесу. КВП являє собою відношення зміни термодина-мічного потенціалу в процесі до його значе-ння в початковому стані.


Знак мінус означає, що в процесі перет-ворення енергії хаотичного руху в енергію направленого руху термодинамічний поте-нціал зменшується.
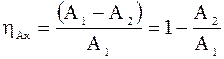
4. Коефіцієнт перетворення енергії (КПЕ)
Позначається  , де t – це перша буква від англ. “transformation”. І тому КПЕ є від-ношення роботи процесу до енергії хаотич-ного руху, яка перетворюється в даному процесі.
, де t – це перша буква від англ. “transformation”. І тому КПЕ є від-ношення роботи процесу до енергії хаотич-ного руху, яка перетворюється в даному процесі.
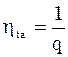 для 1 кг
для 1 кг
 для m кг
для m кг
 .
.
Лекція 7.
Ізотермічний процес.
1. Дати визначення процесу.
Ізотермічним називають процес, який протікає під час постійної температури.
2. Записати рівняння процесу в pv- і Ts-координатах.
pv=RT, T=const
pv=const
3. Треба зобразити цей процес у pv- і Ts-діаграмах.
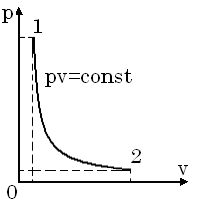
У pv-діаграмі ізотермічний процес зоб-ражується як рівнобока гіпербола.
1-2 – процес розширення.
2-1 – процес стиснення.
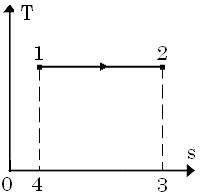
У Ts-діаграмі це горизонтальна пряма.
4. Треба записати співвідношення параметрів.
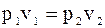

Відношення тисків зворотньопропорці-йне відомим об’ємам.
5. Треба визначити зміну внутріш-ньої енергії в процесі.

 , бо
, бо  .
.
6. Визначають зміну ентальпії у про-цесі.


7. Визначають зміну ентропії у про-цесі.

Так як  , то:
, то:
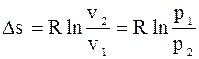 .
.
8. Знайти теплоту процесу.
З Ts–діаграми бачимо, що:
q=площа (1-2-3-4);
 .
.
9. Знайдемо роботу цього процесу.
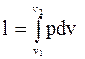 ;
;
pv=RT;
 ;
;
 ;
;
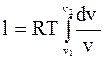 ;
;
 ;
;
 ;
;  ;
;
 .
.
10. Зображуємо схему енергобалансу процесу.
Згідно з I законом термодинаміки:

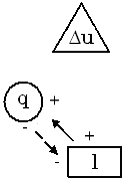
11. Визначаємо коефіцієнт викорис-тання термодинамічного потенціалу в про-цесі (КВП).

У точці 2 термодинамічний потенціал (вільна енергія) рівний нулю:
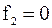 ;
;  .
.
Якщо в ізотермічному процесі до робо-чого тіла підвести меншу кількість теплоти q`< площі (1-2-3-4), тоді процес закінчиться у точці 2`. Тобто, не буде використаний весь термодинамічній потенціал f, що приведе до зменшення потужності двигуна.

12. Знаходимо коефіцієнт перетворе-ння енергії в процесі (КПЕ).

Це є відношення енергії направленого руху, яка отримана в процесі, до енергії ха-отичного руху, яка приймала участь у цьо-му процесі.

Ізобарний процес
1. Ізобарним називають процес, який протікає при сталому тиску.
2. Рівняння ізобарного процесу у pv-діаграмі:
Р=const
У Ts-діаграмі
 ;
;
 ;
;
 .
.
3. Зобразимо цей процес в pv–діаг-рамі та Ts–діаграмі:

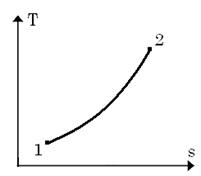
У Ts-діаграмі це логарифмічна крива.
4. Співвідношення параметрів ста-ну.
 поділимо на
поділимо на  .
.
Отримаємо:  .
.
5.  .
.
6.  .
.
7.  .
.
8. Теплота процесу:
 .
.
9. 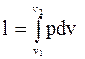 ; P=const;
; P=const;  .
.
10. Схема енергобалансу

11. КВП:
 , де
, де  – вільна ентальпія.
– вільна ентальпія.
12. КПЕ:
 .
.
Ізохорний процес
1. Ізохорним називають процес, який протікає при сталому об’ємі.
2. Рівняння ізохорного процесу в pv-діаграмі: v=const.
У Ts–діаграмі:
 .
.
3. У pv-діаграмі це вертикальна пряма.

У Ts-діаграмі це логарифмічна крива.

1-2 – ізобара P=const.
1-3 – ізохора V=const.
Якщо у Ts-діаграмі через одну і ту ж то-чку проходить і ізобара, і ізохора, то ізобара йде більш полого, а ізохора – більш круто.
 ;
;  ;
;
 .
.
4. Написати співвідношення для па-раметрів стану.
 поділимо на
поділимо на  .
.
Отримаємо:  .
.
5.  .
.
6.  .
.
7.  .
.
8.  .
.
9. 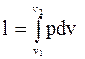 ;
;  ;
;  .
.
d(pv)=vdp+pdv;
pdv=0;
 .
.
10. Схема енергобалансу:
 .
.

11. КВП:
 .
.
12. КПЕ:
 .
.
Це в тому випадку, якщо розглядати роботу розширення:
 .
.
Адіабатний процес
1. Адіабатним називають процес, який протікає без теплообміну з навколиш-нім середовищем.
2. 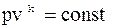 у pv-діаграмі.
у pv-діаграмі.
 ,
,
де k – показник адіабати.
У Ts-діаграмі:
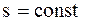 .
.
У адіабатному процесі ентропія зали-шається незмінною.
3. Зображення цих процесів у pv-ді-аграмі – нерівнобока гіпербола.

Якщо у pv-діаграмі через одну і ту ж то-чку проходить адіабата і ізотерма, то адіа-бата йде більш круто, а ізотерма – більш полого.
4.  ;
;

5.  .
.
6.  .
.
7.  .
.
8. 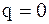 .
.
9.  ;
;  ;
;
 (1)
(1)
 ;
; 
 ;
;
 (2)
(2)
 (3)
(3)
 .
.
Підставимо замість 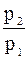
 :
:
 (4)
(4)
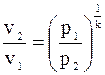 ;
;
 (5)
(5)
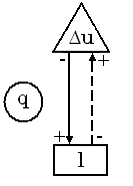
10. Схема енергобалансу.
Політропний процес
1. Політропним називають процес, у якому енергія перетворюється за наступ-ним законом:
2. 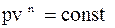 , n – показник політро-пи:
, n – показник політро-пи:  .
.
 – теплоємність політропного процесу:
– теплоємність політропного процесу:
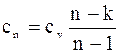 .
.
3.  .
.
4. Оскільки рівняння політропи ззо-вні схоже з рівнянням адіабати, тільки за-мість k маємо показник політропи n, то всі рівняння адіабатного процесу справедливі для політропного, лише в них треба замі-нити k на n:



Політропний процес перетворюється в основні термодинамічні процеси під час певних значень показника політропи.
Якщо n=0: 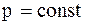 .
.
Тобто, маємо ізобарний процес.
n=1: 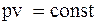 – ізотермічний процес.
– ізотермічний процес.
n=k: 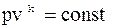 – адіабатний процес.
– адіабатний процес.
n=∞:  ;
;
 настільки більша
настільки більша  , що в даному ви-падку ним можемо знехтувати, тому:
, що в даному ви-падку ним можемо знехтувати, тому:
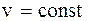 – ізохорний процес.
– ізохорний процес.
5.  .
.
6.  .
.
7.  .
.
8.  .
.
9. 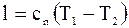 ;
;
 ;
;
 ;
;
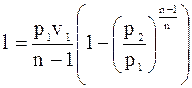 ;
;
 .
.
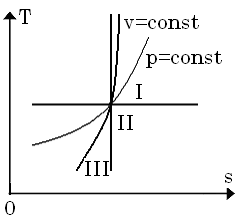
10. У залежності від значення показ-ника політропи, всі процеси розподіляють-ся на три групи:
I. 0<n<1


II. 1<n<k


Політропні процеси другої групи є най-більш ефективні, так як в них робота вико-нується як за рахунок теплоти, яка підво-диться до робочого тіла, так і за рахунок внутрішньої енергії.
III. k<n<∞

Це найневигідніші процеси.
У Ts-координатах:
Тема 3
Механізм отримання роботи
Слід визначити, яким чином змінюєть-ся енергія тіла під час виконання ним ро-боти. Для цього розглянемо Te-діаграму, де зобразимо всі складові частини енергії ро-бочого тіла. По осі ординат відкладемо аб-солютну температуру, а по осі абсцис – ене-ргію в 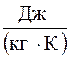 .
.
Точка 1 характеризує початковий стан робочого тіла. По осі абсцис відкладемо значення 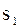 точки 1. Відкладемо теплоєм-ність тіла під час сталих об’єму (
точки 1. Відкладемо теплоєм-ність тіла під час сталих об’єму (  ) і тиску (
) і тиску (  ). Отримаємо декілька площин.
). Отримаємо декілька площин.

Площа а-1-6-0 еквівалентна зв’язаній енергії робочого тіла,  .
.
Площа а-2-5-0 – внутрішня енергія ро-бочого тіла  .
.
Тоді, так як 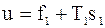 , то площа 1-2-5-6 – це є вільна енергія
, то площа 1-2-5-6 – це є вільна енергія  .
.
Площа а-3-4-0 – рівна ентальпії  .
.
Відома формула Р. Майєра  дорівнює відрізку 5-4. Тоді площа 2-3-4-5 еквівалентна
дорівнює відрізку 5-4. Тоді площа 2-3-4-5 еквівалентна 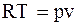 .
.
Припустимо, є гаряче джерело  , від якого теплота підводиться до робочого тіла в ізотермічному процесі. Тобто, під час під-ведення теплоти стан робочого тіла буде змінюватись за ізотермою 1-2. Прослідкує-мо, які зміни енергії робочого тіла будуть протікати під час цього ізотермічного про-цесу. Перший закон q=* u + l
, від якого теплота підводиться до робочого тіла в ізотермічному процесі. Тобто, під час під-ведення теплоти стан робочого тіла буде змінюватись за ізотермою 1-2. Прослідкує-мо, які зміни енергії робочого тіла будуть протікати під час цього ізотермічного про-цесу. Перший закон q=* u + l
 .
.
Так як це ізотермічний процес, то:
 і
і  .
.
 ;
;
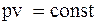 ;
; 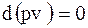 .
.
У процесі виконується робота  . Тоді ро-бимо висновок, що
. Тоді ро-бимо висновок, що  . Ця залежність є чисто кількісна, і вона не відповідає фізич-ному змісту цього процесу. Тобто, прослід-куємо, які ще зміни енергії робочого тіла протікають в ізотермічному процесі. По мі-рі підведення теплоти буде змінюватись стан робочого тіла. Точка 1 буде пересува-тись у напрямку 2, і у точці 2 закінчиться ізотермічний процес. Під час цього буде зменшуватись вільна енергія і збільшува-тись зв’язана енергія. У стані 1` збільши-лась зв’язана енергія до площі а-1`-5`-0, а вільна енергія зменшилася до площі 1`-2-5-5`. У точці 2 вся вільна енергія переходить у зв’язану, і робоче тіло втрачає здатність перетворювати теплоту у роботу. Останню робоче тіло виконує шляхом зміни потенці-альної енергії тиску робочого тіла.
. Ця залежність є чисто кількісна, і вона не відповідає фізич-ному змісту цього процесу. Тобто, прослід-куємо, які ще зміни енергії робочого тіла протікають в ізотермічному процесі. По мі-рі підведення теплоти буде змінюватись стан робочого тіла. Точка 1 буде пересува-тись у напрямку 2, і у точці 2 закінчиться ізотермічний процес. Під час цього буде зменшуватись вільна енергія і збільшува-тись зв’язана енергія. У стані 1` збільши-лась зв’язана енергія до площі а-1`-5`-0, а вільна енергія зменшилася до площі 1`-2-5-5`. У точці 2 вся вільна енергія переходить у зв’язану, і робоче тіло втрачає здатність перетворювати теплоту у роботу. Останню робоче тіло виконує шляхом зміни потенці-альної енергії тиску робочого тіла.
Кількісно 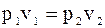 , якісно – це різні енергії.
, якісно – це різні енергії.

У процесі переходу вільної енергії у зв’язану змінюється потенціальна енергія тиску газу.

Для ізотермічного процесу:

Низка перетворень при виконанні робо-ти робочим тілом:
 .
.
Таким чином, під час підведення тепло-ти робота виконується за рахунок зміни якості енергії робочого тіла.
Лекція 8. 8.10..
 (1)
(1)
 (2)
(2)
За виразом Клаузіуса:

Із рівняння (1) видно, що теплота не впливає безпосередньо на зв’язану енергію, і тому між ними нема фізичного зв’язку, а є тільки кількісний. Рівняння (2) для різних основних термодинамічних процесів має рі-зний вигляд, тобто, механізм отримання роботи в різних процесах різний. Так, для ізотермічного процесу ( 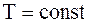 ) ми бачи-мо, що
) ми бачи-мо, що  і
і 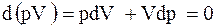 . Таким чином,
. Таким чином,  .
.
З урахуванням зазначеного вище:
 (3)
(3)
Для ізобарного процесу ( 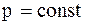 ):
):
 (4)
(4)
Для ізохорного процесу ( 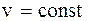 ):
):
*Q =- dF = TdS+SdT=d(pV) = Vdp=-* L
(5)
Для адіабатного процесу (  ):
):
 ;
;

Вираз 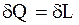 не дає можливості прове-сти глибокий аналіз процесів, які прохо-дять під час перетворення енергії.
не дає можливості прове-сти глибокий аналіз процесів, які прохо-дять під час перетворення енергії.
Тема 4
Водяна пара як реальний газ
Последнее изменение этой страницы: 2016-07-23
lectmania.ru. Все права принадлежат авторам данных материалов. В случае нарушения авторского права напишите нам сюда...