
Категории:
ДомЗдоровьеЗоологияИнформатикаИскусствоИскусствоКомпьютерыКулинарияМаркетингМатематикаМедицинаМенеджментОбразованиеПедагогикаПитомцыПрограммированиеПроизводствоПромышленностьПсихологияРазноеРелигияСоциологияСпортСтатистикаТранспортФизикаФилософияФинансыХимияХоббиЭкологияЭкономикаЭлектроника
Другий закон термодинаміки (стор. 77-92)
Другий закон вивчає напрямок та гли-бину протікання термодинамічних процесів. Важлива задача полягає також у дос-лідженні необоротності протікання термо-динамічних процесів. Розглянемо ізольова-ну термодинамічну систему.
 ,
,
 ,
,  ,
,  ;
; 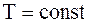 .
.
Так як це ізольована система, то немає теплообміну з навколишнім середовищем. Таким чином: так як TdS=0 і
 . (1)
. (1)
Розглянемо ізольовану термодинамічну систему, коли в ній протікає необоротний процес – під час наявності тертя, на подолання якого необхідні витрати енергії. Система ізольована, тому ззовні енергія не поступає.
Кількість енергії ізольованої системи не змінюється.
dH=0
Тоді ми беремо термодинамічну тотож-ність, що дає:
TdS=dH-Vdp;
dH=0;
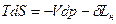 .
.
Тертя в необоротному процесі долається за рахунок наявної роботи, і в цьому ви-падку:
TdS>0
T>0
dS>0 (2)
Об’єднаємо перший і другий вирази:
dS≥0 (3)
Вираз (3) зображує принцип зростання ентропії і є математичним виразом другого закону термодинаміки:
Ентропія ізольованої системи залишає-ться незмінною, якщо в цій системі проті-кають оборотні процеси, і зростає, якщо в цій системі протікають необоротні процеси, але ніколи не може зменшуватись.
Цей закон дає можливість визначити напрямок і глибину протікання термоди-намічного процесу. Довільні термодинамічні процеси протікають у напрямку збільшення ентропії і зупиняються під час досягнення ентропією максимального значення.


Процес буде протікати в напрямку під-вищення ентропії.


Теплота і робота є вектори, і знаками „+” і „-” позначається напрямок вектора. Якщо стоїть –Q, то це значить, що теплота відводиться від робочого тіла.
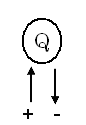
Якщо робота виконується робочим тілом, то L матиме знак „+”, якщо над робочим тілом – знак „-”.


Джерелом енергії називається тіло, те-мпература якого не змінюється під час від-ведення від нього теплоти, або під час під-ведення до цього тіла теплоти.
Розглядають гаряче джерело  , холодне джерело
, холодне джерело  та двигун.
та двигун.

Треба визначити зміну ентропії системи. Вона дорівнює сумі змін компонентів системи.




 , бо
, бо  .
.
Таким чином, згідно з другим законом термодинаміки, система, яка перетворює енергію хаотичного руху в роботу, повинна складатись з трьох тіл: гарячого джерела, двигуна і холодного джерела.
Постулат Клаузіуса виражає також дру-гий закон термодинаміки (друге формулювання): теплота не може передаватись від менш нагрітого тіла до більш нагрітого без витрати на то енергії. За цим принципом працюють холодильні установки.
Третє формулювання другого закону термодинаміки:
Неможливо побудувати вічний двигун другого роду: нема і не може бути такого двигуна, який би всю витрачену теплоту перетворював би в роботу.
Четверте формулювання другого закону термодинаміки:
Рушійна сила системи не залежить від природи робочого тіла, а залежить виключно від температур гарячого і холодного джерел.
Лекція 6.
Термодинамічні потенціали та їх диференціальні рівняння (стор. 59-77)
Термодинамічним потенціалом нази-вається величина, зменшення якої дорів-нює роботі, яка виконується системою під час певних умов. Розглядають чотири тер-модинамічні потенціали:
1. F – вільна енергія.
U=F+TS (1)
Звідси F=U-TS (2)
В диференціальному вигляді
dF=dU-TdS-SdT (3)
Розглядаючи перший закон термодинаміки:
TdS=dU+pdV
dU=TdS-pdV (4)
(4) підставимо в (3):
dF=TdS-pdV-TdS-SdT
dF=-SdT-pdV (5)
2. G – вільна ентальпія.
H=G+TS
G=H-TS
dG=dH-TdS-SdT (6)
TdS=dH-Vdp, (7)
де Vdp – наявна робота.
dH=TdS+Vdp (8)
(8) підставимо в (6):
dG=TdS+Vdp-TdS-SdT
dG=Vdp-SdT (9)
Це диференціальне рівняння вільної ентальпії.
3. U – внутрішня енергія.
TdS=dU+pdV
dU=TdS-pdV (10)
Це диференціальне рівняння для внутрішньої енергії.
4. H – ентальпія.
З рівняння (7) отримаємо:
dH=TdS+Vdp (11)
Це диференціальне рівняння для ентальпії.
Обчислення ентропії
Ентропія є параметр стану і її зміна процесів знаходиться в залежності від будь-якої пари основних параметрів стану. Тобто, ентропія є функція будь-яких двох параметрів стану:



1) 
Вираз Клаузіуса говорить, що
 (1)
(1)
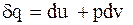 (2)
(2)
(2) підставимо в (1):
ds=du/T+pdv/T (3)
 (4)
(4)
pv=RT (5)
p=RT/v (6)
(4) і (6) підставимо в (3):
 (7)
(7)
Проінтегруємо вираз (7):
 (8)
(8)
Зміна ентропії як функція (T,v).
2) 
 (9)
(9)
Запишемо перший закон термодина-міки у вигляді:
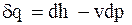 (10)
(10)
Підставимо (10) у (9):
ds=dh/T-vdp/T (11)
Із закону Джоуля ми знаємо, що:
 (12)
(12)
З рівняння стану:
pv=RT
v=RT/p (13)
(12) і (13) підставимо в (11):
 (14)
(14)
Проінтегруємо вираз (14):
 (15)
(15)
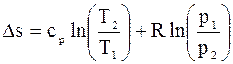 (16)
(16)
3) 
Запишемо рівняння стану для двох станів.
 (17)
(17)
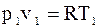 (18)
(18)
Поділимо (17) на (18):
 . (19)
. (19)
Підставимо (19) у (8):
 .
.
(19) підставимо в (15):
 (20)
(20)
 (21)
(21)
Тоді остаточно отримаємо:
 . (22)
. (22)
Допустимо, що ентропія під час Т=273К дорівнює нулю.
 ,
,  .
.
Припустимо, є температура, що зміню-валась від 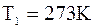 до
до  . Тоді:
. Тоді:
 .
.
Тема 2
Последнее изменение этой страницы: 2016-07-23
lectmania.ru. Все права принадлежат авторам данных материалов. В случае нарушения авторского права напишите нам сюда...