
Категории:
ДомЗдоровьеЗоологияИнформатикаИскусствоИскусствоКомпьютерыКулинарияМаркетингМатематикаМедицинаМенеджментОбразованиеПедагогикаПитомцыПрограммированиеПроизводствоПромышленностьПсихологияРазноеРелигияСоциологияСпортСтатистикаТранспортФизикаФилософияФинансыХимияХоббиЭкологияЭкономикаЭлектроника
Фотометрия светорассеивающих систем
Ослабление светового потока при прохождении света через кювету с суспензией происходит вследствие его рассеяния и поглощения частицами дисперсной фазы и раствором:
I0 = In + Ir + I,
где I0, In, Ir, I– интенсивности падающего, поглощаемого, рассеянного и прошедшего световых потоков соответственно.
Зависимость Ir от влияющих факторов подчиняется закону Рэлея:
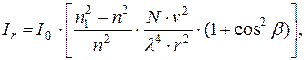
где n1, n – коэффициенты преломления соответственно частиц и среды; N – число частиц в 1 см3 объема; v – объем частицы; λ – длина волны падающего света; r – расстояние до наблюдателя; β – угол между направлениями исходного и рассеянного световых потоков.
В условиях фотометрического анализа дисперсных систем величины n1, n, r и β постоянны. Следовательно, можно записать
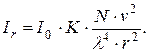
Последнее выражение позволяет сделать вывод о линейной зависимости между Ir и концентрацией частиц осаждаемого вещества в единице объема раствора N. Такая зависимость возможна лишь при условии одинакового размера частиц осадка.
Количественный анализ светорассеивающих систем осуществляют одним из двух методов – турбидиметрическим или нефелометрическим.
Метод нефелометрии основан на измерении величиныIpкак функции концентрации. Закон Рэлея для конкретных условий фотометрирования на данном приборе можно представить в виде
Ip = I0 · k · C · V,
где k – постоянная величина; С – концентрация ионов, дающих нерастворимую аналитическую форму; V – объем частиц осадка.
При турбидиметрических измерениях оценивают Iв сравнениис I0,используя параметр, аналогичный оптической плотности и называемый мутностью раствора (S):
S = lg (I0/I ).
Прямая нефелометрия более чувствительный метод, чем прямая турбидиметрия. Однако количественный анализ по градуировочной зависимости характеризуется недостаточной воспроизводимостью и большой относительной ошибкой (10 - 15 %). Поэтому чаще используют титрование, турбидиметрически или нефелометрически определяя точку эквивалентности.
Нефелометрическое титрование раствора соли кальция oкcалатoм аммония (работа № 7)
Цель работы: изучение основ фотометрирования светорассеиваю-щих растворов; определение концентрации ионов кальция методом нефелометрического титрования.
Сущность метода.При нефелометрическом титровании строят график зависимости «Ip – C», на котором в точке эквивалентности наблюдается излом (рис. 1.18).
Оборудование:1)нефелометр ЛМФ-69; 2) бюретка на 25 см3; 3) стаканы на 100 см3; 4) мерная колба на 100 см3; 5) пипетка на 10 см3.
Реактивы: 1) 0,025 н. стандартный раствор соли Са2+; 2) 0,025 н. стандартный раствор оксалата аммония; 3) ацетон.

Рис. 1.18. Вид кривой нефелометрического титрования
раствора соли кальция oкcалатoм аммония
Ход работы. Отбирают 5 см3 стандартного раствора соли кальция и помещают в стакан на 100 см3. Приливают туда 30 см3 ацетона и 40 см3 дистиллированной воды. В стакан помещают магнитный элемент и устанавливают в гнездо прибора.
Включают магнитную мешалку и перемешивают раствор до полного удаления пузырьков (около 10 мин). Воронка на поверхности раствора не должна попадать в световой поток.
Затем из бюретки в стакан приливают отдельными порциями по 1,0 см3 стандартный раствор оксалата аммония. После прибавления каждой новой порции титранта выжидают несколько минут, пока стрелка прибора не остановится. Записывают показания миллиамперметра и отсчеты по бюретке.
Если стрелка прибора при добавлении 3 – 4 порций оксалата (по 1,0 см3) не изменяет положения, титрование закончено.
Результаты заносят в таблицу и наносят на миллиметровую бумагу, откладывая по оси ординат показания миллиамперметра, а по оси абсцисс – объем прибавленного осадителя. Концентрацию ионов кальция в рас-творе находят исходя из закона эквивалентов:
Сн(Сa2+) · V(Ca2+) = Сн(С2О42–) · V(C2O42–),
где Сн – молярная концентрация эквивалентов соответствующего вещест-ва, моль/дм3; V – объем раствора, дм3.
Определив Сн(Сa2+), рассчитывают массу кальция в пробе. Посколь-ку в данном случае известно количество взятого стандартного раствора, можно оценить погрешность метода.
Аналогично титруют и проводят расчеты для раствора, содержащего задачу (при этом полностью соблюдая последовательность всех стадий).
Контрольные вопросы
1. Закон светорассеяния Рэлея.
2. Отличие метода турбидиметрии от нефелометрии.
3. Факторы, влияющие на условия измерения, и их учет.
4. Напишите формулы коллоидных мицелл оксалата кальция до и после точки эквивалентности.
5. Условия применения методов сравнения, градуировочного графи-ка и титрования для анализа. Преимущества и недостатки каждого из них.
6. Точность измерений в фотометрии светорассеивающих систем.
Литература
Пршибил, Р. Аналитическое применение этилендиаминтетрауксус-ной кислоты и родственных соединений. М.: Мир, 1975.
Люминесцентный анализ
Люминесценция – избыточное по сравнению с тепловым излучение, возникающее через некоторое время (Δτ > 10–8 с) после поглощения веществом энергии извне. Если излучение возникает в результате поглощения излучения рентгеновского или ультрафиолетового диапазона, его называют флуоресценцией. Процессы в многоатомной молекуле, приводящие к флуоресценции, позволяет обсудить энергетическая схема, представленная на рис. 1.19.
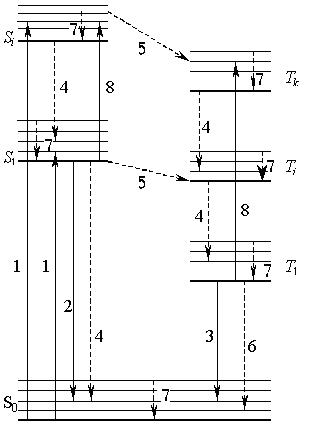
Рис. 1.19. Энергетическая схема многоатомной молекулы:
1 – поглощение; 2 – флуоресценция; 3 – фосфоресценция; 4 – внутренняя конверсия; 5 – синглет-триплетная конверсия; 6 – Т1 – S0 – конверсия; 7 – колебательная релаксация; 8 – синглет-синглетное и триплет-триплетное перепоглощение
1.5.1. Природа люминесцентного излучения
Изображены основной S0 и возбужденные (синглетные S1и триплетные T1) электронные уровни молекулы. Синглетному состоянию соответствуют антипараллельные спины электронов, триплетному – параллельные. Переход основного синглетного в возбужденное триплетное состояние запрещен по спину и практически не наблюдается. В пределах каждого электронного уровня имеются колебательные подуровни. Излучательный переход S0 → S1называют флуоресценцией, спонтанный T1 → S0 – фосфоресценцией.
В рассматриваемой системе наблюдаются процессы безызлучатель-ной дезактивации – неоптические (не сопровождающиеся непосредственно излучением фотона) переходы между электронными состояниями, при которых энергия электронного возбуждения полностью или частично преобразуется в колебательную энергию системы. Различают два вида безызлучательной конверсии – внутреннюю и интеркомбинационную. Первая имеет место между электронными состояниями одной мультиплетности (Sn → Sm, S0 → S1, Tl → Tk), вторая – между состояниями разной мультиплетности (Sn → Tm, T1 → S0). Безызлучательный переход в основное состояние часто называют деградацией (S1 → S0, Т1 → S0). Имеет место еще один вид безызлучательных переходов – колебательная релаксация, которая в отличие от внутренней конверсии протекает в рамках одного электронного состояния и приводит к установлению равновесного распределения энергии по колебательным уровням электронного состояния возбужденной молекулы в результате внутримолекулярных взаимодействий и (или) взаимодействия со средой. При безызлучательных переходах теряется часть поглощенной энергии и излучение наблюдается при большей длине волны, чем λ поглощенного кванта.
1.5.2. Закономерности флуоресценции
Правило Стокса. Спектр флуоресценции многоатомных молекул представляет широкую структурную или бесструктурную полосу, сдвинутую в сторону длинных волн относительно спектра поглощения.
Правило Стокса означает, что молекула излучает не всю поглощенную энергию, часть поглощенной энергии тратится на внутримолекулярные преобразования. Иными словами, данное правило указывает, что частота излучаемого кванта (vf) должна быть меньше частоты поглощенного кванта (vа), т.е. hvf < hvа.
Важными характеристиками флуоресценции являются квантовый выход
Вкв = nизл / nпогл,
энергетический выход
Вэн = Еизл / Епогл,
где nизл, nпогл– соответственно число излученных и поглощенных квантов, а Еизл, Епогл –энергия излученных и поглощенных квантов.
Правило М.Каша(1950 г.): в большинстве молекул процессы внутренней конверсии между электронно-возбужденными состояниями протекают за время, меньшее, чем 10–11 с, и заметный квантовый выход флуоресценции может наблюдаться только для переходов из нижнего возбужденного состояния данной мультиплетности.
Закон С.И. Вавилова (1924 г.): квантовый выход флуоресценции остается постоянным при возбуждении различными длинами волн на всем протяжении полосы поглощения вплоть до некоторой предельной величины λ0. Закон Вавилова в конденсированных средах обусловлен тем, что вследствие межмолекулярных взаимодействий происходит передача в среду избытка над равновесным значением колебательной энергии в электронно-возбужденном состоянии и устанавливается равновесное распределение по колебательным степеням свободы.
Закон зеркальной симметрии.В 1931 г. В.Л. Левшиным было обнаружено, что контур полосы флуоресценции является зеркальным отражением длинноволновой полосы поглощения (оба спектра построены в шкале частот). Как показал Б.И. Степанов, для выполнения правила зеркальной симметрии необходимо наличие равновесного распределения поглощенной энергии по колебательным степеням свободы в состоянии S1, т.е. высокой скорости колебательной релаксации во флуоресцентном состоянии, что характерно только для сложных по строению молекул.
1.5.3. Факторы, влияющие на интенсивность флуоресценции
Зависимость интенсивности флуоресцентного излучения I от концентрации излучающего вещества С проходит через максимум. Для очень малых значений С (от 0 до 10–3 моль/дм3) наблюдается линейная зависимость
I = k · С.
Дальнейшее увеличение С приводит к концентрационному тушению флуоресценции. Типичная зависимость представлена на рис. 1.20. В диапазоне от 0 до 15 мкг/см3 соблюдается линейная зависимость интенсивности флуоресценции от концентрации фенола. В этом диапазоне обсуждаемым методом успешно осуществляется количественный анализ при высокой чувствительности.
Повышение температуры усиливает колебательные переходы в молекулах и резко снижает интенсивность флуоресценции (температурное тушение). Измерения желательно проводить при более низкой температуре, используя термостатирование.
На интенсивность флуоресценции существенное влияние оказывает кислотность раствора. Например, максимум спектра флуоресценции акридина при изменении рН от 7 до 4 смещается от 430 до 475 нм. При этом изменяется и форма спектра. Характер зависимости от рН индивидуален для каждого исследуемого вещества, и влияние этого фактора существенное. Поэтому рекомендуется аналитические определения проводить в буферных средах.

Рис. 1.20. Влияние концентрации фенола в водном растворе
на интенсивность его флуоресценции
Для флуоресценции многих веществ характерно тушение излучения посторонними веществами. Этот эффект применяется в количественном анализе. На рис. 1.21 приведена зависимость интенсивности флуоресцен-ции родаминового раствора от содержания в нем ионов Zn2+. Градуировочная кривая, построенная по эталонным растворам, позволяет вести количественное определение концентрации цинка.

Рис. 1.21. Влияние концентрации ионов цинка
на интенсивность флуоресценции родаминового раствора
Флуориметрические измерения проводят на флуориметрах (рис. 1.22) – приборах, позволяющих выделить в падающем на кювету световом потоке при помощи светофильтра 2 длину волны ультрафиолето-вого диапазона, соответствующую максимуму поглощения молекулами или ионами анализируемого вещества. Второй светофильтр 4 выделяет в световом потоке вторичного (флуоресцентного) излучения длину волны, соответствующую максимуму интенсивности излучения.
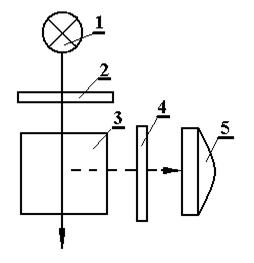
Рис. 1.22. Принципиальная оптическая схема флуориметра:
1– источник света; 2 – светофильтр; 3 – кювета;
4 – светофильтр; 5 – приемник света
1.5.4. Флуориметрическое определение бора в виде соединения с бензоином (работа № 8)
Цель работы: освоение флуориметрического метода; количест-венный анализ бора.
Сущность метода. Флуоресценция (разновидность люминесценции) представляет собой вторичное излучение молекул в короткий период времени непосредственно после поглощения инициирующего ультра-фиолетового излучения. Длина волны вторичного излучения больше, чем инициирующего. Для очень разбавленных растворов наблюдается линейная зависимость интенсивности флуоресценции от концентрации. Бор образует с бензоином комплекс, обладающий способностью к флуоресценции. При проведении реакции в щелочной водно-спиртовой среде облучаемый ультрафиолетовыми лучами раствор дает светло-голубое свечение с максимумом излучения около 480 нм.
Оборудование: 1) фотометр лабораторный ЛМФ-72 или ЛМФ-72 М; 2) колбы мерные на 25 см3 – 7 шт.; 3) пипетки градуированные на 5 см3 – 2 шт.; 4) пипетка на 15 см3 – 1 шт.; 5) бюретка на 50 см3 (для этанола); 6) стаканы на 100 см3 – 3 шт.; 7) стакан для слива на 300 см3.
Реактивы: 1) стандартный раствор бора, 20 мкг/см3 (в мерной колбе на 1000 см3 растворяют 0,112 г Н3ВО3 и доводят до метки 2%-ным раствором Na2CO3); 2) этанол (95%-ный); 3) буферный раствор с рН = 12,8 (в 50 см3 0,4%-ного раствора NaOH растворяют 0,375 г этиленгликоля; 0,30 г NaCl и 0,50 г NH4F и доводят дистиллированной водой до 500 см3); 4) 0,5%-ный раствор бензоина в 95%-ном этаноле.
Ход работы. В мерные колбы на 25 см3 помещают 1, 2, 3, 4 и 5 см3 стандартного раствора бора. Добавляют по 15 см3 этанола, 3 см3 буферного раствора, 2 см3 раствора бензоина и водой доводят объем до метки. Одновременно аналогично готовят задачу и нулевой раствор, содержащий все компоненты, кроме бора. Через 5 мин после сливания и перемешивания реагентов измеряют интенсивность флуоресценции эталонных растворов и задачи. По полученным данным строят калибровочный график в координатах «деления шкалы прибора – концентрация бора в пробе». Обрабатывают его по методу наименьших квадратов. Рассчитывают доверительный интервал для концентрации бора в пробе. Результат анализа определяют по графику.
Порядок флуориметрических измерений на приборе ЛМФ-72 М:
1. Включить прибор для прогрева в течение 0,5 ч (все кнопки отжаты).
2. Поворотный столик с кюветодержателем установить в положение 0.
3. В кюветодержатель поставить слева кювету с растворителем, справа с раствором максимальной концентрации (кюветы l = 2 см).
4. Нажать кнопку Ф (флуориметр).
5. Повернуть столик в положение И.
6. Ручками «0 грубо, точно» вывести стрелку на 0.
7. Повернуть столик в положение 100.
8. Ручками «100 грубо, точно» и вращением ручки диафрагмы вывести стрелку на 100. Если не удается вывести стрелку на 100, нажмите кнопку расширитель и повторите настройку.
9. Запишите показания прибора. Затем выньте кювету с раствором наибольшей концентрации. Смените раствор в кювете. Установите ее в кюветодержатель. Проведите измерение интенсивности флуоресценции для стандартных растворов и задачи.
Следите за чистотой поверхностей кювет и однообразностью их размещения в кюветодержателе.
Контрольные вопросы
1. Происхождение люминесценции. Природа явления. Классификация.
2. Закономерности флуоресценции (правило Стокса, правило зер-кальной симметрии).
3. Квантовый и энергетический выход. Закон Вавилова.
4. Факторы, влияющие на флуоресценцию. Зависимость интенсив-ности флуоресценции от концентрации раствора, температуры, рН.
5. Тушение флуоресценции ионами d-металлов. Применение этого явления для количественного анализа.
6. Принцип работы флуориметра и его основные узлы.
7. Методы измерения в люминесцентном анализе.
Литература
1.Турро, Н. Молекулярная фотохимия / Н. Турро. М.: Мир, 1967.
2. Борковский, В.Ф. Основы физико-химических методов анализа / В.Ф. Борковский В.Ф., Т.Б. Городенцова, Н.Б. Топорова. М.: Высшая школа, 1983.
Другие оптические методы
В современных аналитических лабораториях широко распростра-нены рефрактометрия и поляриметрия, относящиеся к физическим методам количественного анализа. Их часто рассматривают в курсе физико-химических методов анализа.
1.6.1. Поляриметрический анализ
Поляриметрический анализ основан на измерении угла вращения плоскополяризованного света при его прохождении через исследуемый раствор. Метод применим только при анализе растворов оптически активных соединений (например, при определении концентрации раствора сахарозы).
Угол вращения плоскости поляризованного света β является линейной функцией концентрации оптически активного вещества в растворе:
β = α ∙ l ∙ C,
где α – удельное вращение; l – толщина слоя раствора; С – концентрация. Удельное вращение плоскости поляризованного света зависит от длины волны, температуры и природы оптически активного вещества. Следовательно, первые два параметра в условиях количественных измерений должны быть постоянными. Количественный анализ одного оптически активного вещества проводят методом градуировочного графика. Смесь оптически активных соединений можно анализировать спектрополяриметрически – путем измерения β при различных значениях λ.
1.6.2. Рефрактометрический анализ
Определение коэффициента преломления (n) раствора позволяет при соблюдении ряда условий осуществлять количественный анализ.
Используют два подхода к определению n. Согласно рис. 1.23а
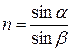 ,
,
для полного внутреннего отражения (рис. 1.23б)
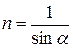 .
.

Рис. 1.23. Методы определения коэффициента преломления:
а – по углам падения и преломления;
б – по углу полного внутреннего отражения
Приведенные выше формулы позволяют рассчитать относительное значение коэффициента преломления. Абсолютные значения соответствуют преломлению и отражению на границе раздела «исследуемое вещество – вакуум». Коэффициент преломления в бинарном растворе является линейной функцией концентрации компонента. На величину n оказывают влияние природа вещества (поляризуемость молекул), длина волны и температура. При точных измерениях необходимо термостатирование исследуемого раствора.
В общем случае для количественного анализа двухкомпонентных растворов используют метод градуировочной зависимости.
Коэффициент преломления – аддитивная величина. Наблюдаемое значение равно сумме коэффициентов преломления компонентов с учетом их долевого содержания. Анализ трехкомпонентных растворов возможен при одновременном измерении еще одного физического параметра системы (чаще всего – плотности). При этом необходимо иметь заранее построенную градуировочную зависимость в виде изолиний коэффициента преломления и плотности раствора на треугольной диаграмме трехкомпонентной системы.
Определение содержания ацетона в водном растворе (работа № 9)
Цель работы: изучение основ рефрактометрического анализа; количественное определение ацетона в водном растворе.
Сущность метода. Для системы «ацетон – вода» анализ проводят методом градуировочной зависимости (рис. 1.24).
Измерение коэффициента преломления раствора проводят при помощи рефрактометра. Схема используемого в данной работе рефракто-метра Аббе приведена на рис. 1.25.
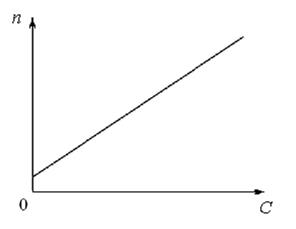
Рис. 1.24. Градуировочный график рефрактометрического анализа
Оборудование: 1) рефрактометр ИРФ-22; 2) колбы мерные на 25 см3 – 8 шт.; 3) градуированная пипетка на 2 см3 – 1 шт.; 4) фильтровальная бумага.
Реактивы: 1) ацетон; 2) вода дистиллированная.

Рис. 1.25. Оптическая схема рефрактометра Аббе (ИРФ-22):
1 – осветительное зеркало; 2 – вспомогательная откидная призма; 3 – основная измерительная призма; 4 – матовая грань откидной призмы; 5 – исследуемая жидкость; 6 – призма Амичи компенсатора; 7 – объектив зрительной трубы; 8 – поворотная призма;
9 – окуляр зрительной трубы
Ход работы. Градуировочная зависимость строится по растворам ацетона в воде известной концентрации. Для этого в колбах на 25 см3 готовят серию растворов с объемной долей ацетона 0; 5; 10; 15; 20; 25 и 30 %. Общий объем растворов 25 см3. Следовательно, для приготовления, например, 10%-го раствора необходимо в колбу на 25 см3 отмерить пипеткой 2,5 см3 ацетона и довести до метки водой.
Рассчитав необходимые объемы ацетона и воды, готовят указанные растворы и измеряют коэффициент преломления n с помощью рефрактометра.
Порядок проведения измерений на рефрактометре ИРФ-22.Поднять измерительную призму. На нижнюю осветительную призму нанести 1 – 2 капли дистиллированной воды. Опустить измерительную призму. Включить лампу. Направить пучок света на место совмещения призм. Окуляр переместить на участок шкалы, соответствующий n = 1,3333. Совместить линию окуляра с границей светлого и темного полей. При отсутствии четкой границы добиться контрастности поворотом осветителя и вращением окуляра. Экспериментальное значение n для чистой воды соответствует показанию шкалы строго напротив черты, нанесенной на стекле окуляра.
Аналогичным образом определяют n для всех эталонных растворов. После каждого измерения призмы необходимо осушить фильтровальной бумагой.
Результаты измерений заносят в таблицу, по данным которой строят градуировочный график, который имеет вид, представленный на рис. 1.24.
Определение коэффициента преломления для задачи проводят таким же образом, как и при построении градуировочного графика.
Контрольные вопросы
1. Рефракция света. Аддитивность рефракции. Коэффициент рефрак-ции. Дисперсия. Влияние температуры на коэффициенты рефракции.
2. Устройство рефктометра Аббе.
3. Области применения рефрактометрии.
4. Количественный анализ растворов методом рефрактометрии. При-менимость методов сравнения и градуировочного графика.
5. Достоинства и ограничения рефрактометрического метода анализа.
Последнее изменение этой страницы: 2016-07-23
lectmania.ru. Все права принадлежат авторам данных материалов. В случае нарушения авторского права напишите нам сюда...