
Главная Случайная страница
Категории:
ДомЗдоровьеЗоологияРнформатикаРскусствоРскусствоКомпьютерыКулинарияМаркетингМатематикаМедицинаМенеджментОбразованиеПедагогикаПитомцыПрограммированиеПроизводствоПромышленностьПсихологияРазноеРелигияСоциологияСпортСтатистикаТранспортФизикаФилософияФинансыХимияХоббиРкологияРРєРѕРЅРѕРјРёРєР°Рлектроника
Рлектрогравиметрическое определение меди (работа в„– 10)
Цель работы: определение процентного содержания меди в образце.
Оборудование: 1) платиновые сетчатые электроды – 2 шт.; 2) выпрямитель; 3) реостат; 4) амперметр; 5) вольтметр; 6) магнитная мешалка; 7) штатив с зажимом для крепления платиновых электродов; 8) цилиндры на 200 см3 (для воды), 100 см3 (для серной кислоты 1:1), 50 см3 (для азотной кислоты 1:1), 50 см3 (для 10%-ной азотной кислоты); 9) стакан на 300 см3 (ячейка), 150 см3 (для спирта); 10) промывалка; 11) ложечка и бюкс для взвешивания.
Реактивы: 1) сульфат меди кристаллический; 2) азотная кислота 1:1, 10% (об.) и концентрированная; 3) серная кислота 1:1; 4) этиловый спирт.
Подготовка к работе.Получить у инженера лаборатории сетчатые платиновые электроды. Большой электрод (катод) взвесить на аналити-ческих весах с точностью до четвертого знака.
Собрать установку для электролиза (СЂРёСЃ. 2.3), закрепить электроды (РёС… нельзя деформировать). Рлектроды вставляют РѕРґРёРЅ РІ РґСЂСѓРіРѕР№ коаксиально Рё так, чтобы между РЅРёРјРё РЅРµ было замыкания. Внешний электрод (катод) подключить Рє клемме «–» выпрямителя, внутренний (анод) – Рє клемме В«+В».
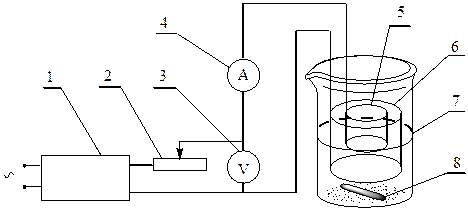
Рис. 2.3. Принципиальная схема прибора для электрогравиметрии: 1 – выпрямитель; 2 – реостат; 3 – вольтметр; 4 – амперметр; 5 – анод; 6 – катод; 7 – уровень раствора в ячейке; 8 – магнитная мешалка
Ход работы. Выполнение учебной задачи. На аналитических весах с точностью до четвертого знака взять навеску сульфата меди (0,3 – 0,5 г), растворить в ячейке в 100 – 200 см3 воды. К полученному раствору доба-вить 30 – 40 см3 азотной кислоты (1:1). Поставить ячейку на столик магнитной мешалки. Опустить в раствор электроды так, чтобы они возвышались над уровнем раствора на 1 – 1,5 см. Опустить в ячейку стек-лянную мешалку. Отрегулировать взаимное расположение электродов и мешалки. Мешалка при вращении не должна касаться электродов.
Включить ток и с помощью реостата установить напряжение в пределах 2 – 2,5 В так, чтобы сила тока была 1,5 – 2 А. Время начала электролиза (включение тока) и силу тока записать в лабораторный журнал.
Через 0,5 ч, не выключая тока, добавить к электролиту 3 см3 серной кислоты (1:1) и 30 см3 азотной кислоты (10%). После этого продолжить электролиз в течение еще 20 мин.
По истечении времени, не выключая тока, поднять электроды из ячейки и опустить их в заранее приготовленный стакан с дистиллирован-ной водой. Затем выключить ток и промыть электроды в стакане со спиртом. Промытые электроды просушить на воздухе 10 мин и взвесить катод на аналитических весах. Вычислить количество выделившейся меди в граммах и процентное содержание меди в исходном образце. Сравнить результат с теоретически рассчитанным. Если данные, полученные опыт-ным путем, согласуются с теоретическим расчетом, можно приступить к контрольной задаче.
Медь, выделившуюся на катоде, растворяют в концентрированной азотной кислоте в вытяжном шкафу. Затем промывают катод сначала водой в стакане, потом водопроводной водой под краном, ополаскивают дистиллированной водой и спиртом. Сушат на воздухе 10 мин. Выливают из ячейки использованный нейтрализованный содой раствор в раковину (не уроните магнитную мешалку).
Выполнение контрольной задачи. Получить задачу у инженера лаборатории и, повторив работу в описанном выше порядке, вычислить содержание меди (%) в исследуемом образце.
Задание
1. Рассчитать теоретическое содержание меди в образце сульфата меди (%) и содержание меди (%) по данным электрогравиметрического определения.
2. Рассчитать количество электричества (Кл), затраченное на проведение электролиза, теоретическое количество электричества и выход по току.
3. Рассчитать относительную ошибку электрогравиметрического определения меди по формуле
 , ,
|
где sg – абсолютная погрешность массы определяемого вещества; sm – абсолютная погрешность массы пробы (сульфата меди); sp – абсо-лютная погрешность массы весовой формы (меди); g – масса меди, г; m – массса навески пробы, г. Принять sm = sp = 0,0002 г.
Контрольные вопросы
1. В чем сущность электрогравиметрического определения металлов? Обсудите достоинства и недостатки метода.
2. Принципиальная схема установки для электрогравиметрии.
3. Какие требования предъявляются к электродам в этом методе аннализа? Какие химические процессы происходят на катоде и аноде при электролизе растворов CuSO4, KCl, Ni(NO3)2?
4. Напишите уравнение закона Фарадея. Как рассчитать электро-химический эквивалент?
5. Какие металлы РЅРµ восстанавливаются РЅР° катоде РёР· водных раство-СЂРѕРІ? Рзобразите диаграмму устойчивости РІРѕРґС‹ РІ координатах «потенциал – СЂРќВ».
6. Для чего к анализируемому раствору добавляют азотную и серную кислоты? Как рассчитывается процентное содержание меди в исходном кристаллогидрате?
7. Объясните расхождение экспериментального и теоретического содержания меди в кристаллогидрате. Рассчитайте содержание кристалли-зационной воды в моль H2O на моль кристаллогидрата.
8. Как учитывают явления поляризации и перенапряжения в электро-гравиметрии? На чем основан выбор рабочего напряжения и силы тока в данном методе анализа?
9. Объясните ход кривой зависимости тока от времени при электро-лизе раствора сульфата меди при контролируемом потенциале (рис. 2.2).
10. В чем сущность кулонометрического метода анализа?
11. Обсудите принципиальную схему инверсионного анализа с предварительным электролитическим концентрированием.
Потенциометрия
Потенциометрия основана РЅР° измерении потенциала ячейки, С‚.Рµ. разности потенциалов между РґРІСѓРјСЏ электродами (индикаторным электродом Рё электроВРґРѕРј сравнения) РІ отсутствие тока РІРѕ внешней цепи. Рто позволяет получить информацию Рѕ химическом составе раствора. Потенциал Рё область применения индикаторного электрода зависят РѕС‚ его РїСЂРёСЂРѕРґС‹ Рё селективности. Р’ потенциометрии возможно измерение потенциала электрода как функции активности (концентрации) определя-емого компонента (прямая потенциометрия) Рё как функции объема реагента, добавляемого Рє РїСЂРѕР±Рµ (потенциометрическое титрование).
Потенциометрическая ячейка
Р’ потенциометрии раствор, содержащий определяемое вещество, активность (концентрацию) которого следует установить, Рё индикаторный электрод РѕР±Вразуют полуэлемент; второй полуэлемент состоит РёР· электрода сравнения. Потенциал индикаторного электрода Еинд линейно зависит РѕС‚ лоВгарифма активности (концентрации) определяемого РёРѕРЅР°. Рлектрод сравнения РІ растворе постоянного состава имеет фиксированный потенциал Еср, РЅРµ Р·Р°Ввисящий РѕС‚ состава анализируемого раствора. РћР±Р° электрода идеально неполяризуемые. Уравнение Нернста связывает потен-циал электрода Рё концентрацию соответствующего РёРѕРЅР° РІ растворе. Поэтому РЅР° основании измерения потенциала обратимого электрода можно рассчитать активность или концентрацию компонента раствора:
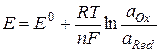 , ,
| (2.1) |
где E0 – стандартный потенциал редокс-системы; R – универсальная газовая постоянная; T – температура, K; F – постоянная Фарадея; n – число электронов, принимающих участие в электродной полуреакции; aOx, aRed – активности соответственно окисленной и восстановленной форм редокс-системы.
Рассмотрим ячейку с индикаторным платиновым электродом, погруженным в раствор, содержащий ионы железа (II) и (III). Второй электрод (электрод сравнения) – насыщенный каломельный (н.к.э.). Наблюдаемая разность потенциалов составляет 0,395 В (25 оС). Рассчитаем процентное содержание железа (III).
Схема ячейки
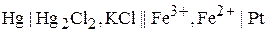
Потенциалы электродов определяются полуреакциями (всегда в форме реакций восстановления):
Fe3+ + e– = Fe2+, E0 = 0,771 В (индикаторный электрод)
Hg2Cl2 + 2 e– = 2 Hg + 2 Cl–, Е0 = 0,246 В (электрод сравнения)
Потенциал ячейки (РДС) Р• описывается следующим уравнением (всегда РёР· большего потенциала вычитают меньший):
Е = (ЕPt – Ен.к.э.) + Еj,
где ЕPt – потенциал индикаторного электрода; Ен.к.э. – потенциал насыщен-ного каломельного электрода; Еj – потенциал жидкостного соединения. Для минимизации Еj используют солевой мостик с насыщенным раствором соли, содержащей ионы с одинаковой подвижностью, например KCl. В правильно составленной потенциометрической ячейке потенциал электрода сравнения постоянен, а Еj постоянен или пренебрежимо мал.
Запишем выражения для потенциалов полуреакций:
EPt = 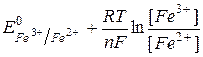
 Р’; Р•0РЅ.Рє.СЌ. = 0,246 Р’
Р’; Р•0РЅ.Рє.СЌ. = 0,246 Р’
Е = ЕPt – E0н.к.э. = 0,771 – 0,246 + 0,0591 
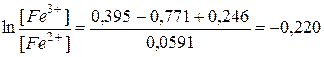
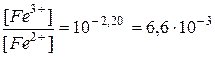
Рто значит, что окислено 0,63% железа (II).
Для РјРЅРѕРіРёС… электродных систем расчет потенциалов РїРѕ уравнению Нернста дает сильные отклонения РѕС‚ реальных значений. Рто связано СЃ тем, что стандартные потенциалы измерены (рассчитаны) для идеальных условий, тогда как для реальных невозможно определить активности или коэффициенты активностей. РџРѕ этой причине используют величину, называемую формальным потенциалом:
 ,
,
где g – соответствующие коэффициенты активности. При подстановке в (2.1) уравнение Нернста будет иметь вид
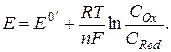
В этом случае состав раствора должен быть точно известен и соответ-ствовать условиям, при которых определен формальный потенциал.
Последнее изменение этой страницы: 2016-07-23
lectmania.ru. Все права принадлежат авторам данных материалов. В случае нарушения авторского права напишите нам сюда...