
Категории:
ДомЗдоровьеЗоологияИнформатикаИскусствоИскусствоКомпьютерыКулинарияМаркетингМатематикаМедицинаМенеджментОбразованиеПедагогикаПитомцыПрограммированиеПроизводствоПромышленностьПсихологияРазноеРелигияСоциологияСпортСтатистикаТранспортФизикаФилософияФинансыХимияХоббиЭкологияЭкономикаЭлектроника
ЭЛЕКТРОХИМИЧЕСКИЕ МЕТОДЫ АНАЛИЗА
Методы анализа, основанные на электрохимических свойствах растворов и окислительно-восстановительных реакциях, протекающих в ячейке (системе из электролита и электродов), называют электрохими-ческими. Различия между методами обусловлены природой электродов и измерительными приборами во внешней цепи. К основным методам электрохимического анализа относят электровыделение, кулонометрию, потенциометрию, вольтамперометрию (полярографию и амперометричес-кое титрование), кондуктометрию.
Электрогравиметрия
Электрогравиметрия относится к старейшим электроаналитическим методам, широко используемым для определения ионов металлов. В настоящее время ее применяют прежде всего для электровыделения металлов из сложных смесей. Анализ основан на электролизе растворов, содержащих соли переходных металлов и осаждении высокочистых металлов на катоде.
Количественные соотношения электролиза установлены Фарадеем (1827 г.). Согласно его закону масса прореагировавшего на электроде вещества m (г) пропорциональна затраченному количеству электричества:
 , ,
|
где Q – количество электричества, Кл; k – электрохимический эквивалент, г/Кл; I – сила тока, А; t – продолжительность электролиза, с.
Электрохимический эквивалент рассчитывают из соотношения
 , ,
|
где М – молярная масса окислителя или восстановителя; n – число электронов, участвующих в полуреакции на данном электроде; F – постоянная Фарадея (96485 Кл/моль).
Для улучшения методики используют потенциостат, позволяющий измерять потенциал катода относительно электрода сравнения. Процесс электролиза можно вести при контролируемом токе или контролируемом потенциале. В качестве катода используют платиновую сетку или фольгу. Металлы, образующие амальгамы, можно осаждать на ртутных электродах.
Электродные реакции
В процессе электролиза химическая реакция протекает в направ-лении, противоположном самопроизвольному при приложении к ячейке постоянного напряжения от внешнего источника. Ячейка состоит из двух электродов, контактирующих с раствором. Внешнее напряжение, наложен-ное на ячейку, распределяется следующим образом:
 ,
,
где Епр = Еа – Ек – ЭДС противоположного направления; Еа – потенциал анода; Ек – потенциал катода; i – ток; R – сопротивление. ЭДС противо-положного направления выражается уравнением
 ,
,
где Еобр – обратимая часть ЭДС ячейки, рассчитанная по уравнению Нерн-ста; h – перенапряжение, характеризующее поляризацию электрода. Разли-чают два типа перенапряжения: концентрационное и активационное.
Концентрационная поляризация имеет место, когда концентрация вещества вблизи электрода отличается от концентрации в объеме раствора. Концентрационное перенапряжение можно уменьшить перемешиванием или работой при низких плотностях тока.
Активационное перенапряжение зависит от природы металла электрода, состояния поверхности, величины тока и других факторов. Оно может изменяться в широких пределах и достигать значения в несколько десятых вольта при разряде некоторых газов на электроде.
В любом случае перенапряжение обуславливает более положитель-ный потенциал анода и более отрицательный потенциал катода по сравнению с равновесными:
 .
.
Электродные реакции, протекающие в электролитической ячейке, требуют приложения минимального внешнего напряжения. Так, если на электроде возможно протекание более одной реакции, то на аноде будет протекать реакция окисления с наименьшим положительным потенциалом, включая перенапряжение. На катоде протекает реакция восстановления с наименьшим отрицательным потенциалом (относительно анода), включая перенапряжение.
При электролизе водных растворов необходимо учитывать возможность окисления и восстановления молекул Н2О, условия устойчивости которой наглядно представляет диаграмма Пурбэ (рис. 2.1). Диаграмма показывает области существования ионов и молекул в зависимости от рН и потенциала электрода (пунктирные прямые харак-теризуют равенство концентраций ионов, находящихся в равновесии). Вертикальные прямые отвечают равновесию на электродах, не зависимому от рН, горизонтальные – ионному равновесию в растворах, наклонные прямые соответствуют электродным процессам, зависящим от рН.
Для процесса на катоде (платиновый электрод)
 .
.
Уравнению на диаграмме соответствует линия 1 при парциальном давлении водорода, равном 1,0. Для окисления воды на аноде – прямая 2 при парциальном давлении кислорода, равном 1,0:
 .
.
При значениях j между линиями 1 и 2 вода устойчива. Пунктирные отрезки прямых 3 – 9 соответствуют равновесиям:
2 Н2О = Н2О2 + 2 Н+ + 2 е– ([Н2О2] = [Н+])
ОН– + Н2О = Н2О2 + Н+ + 2 е– ([OH– = [H2O])
H2O2 = HO2– + H+ ([H2O2] = [HO2–])
OH– + H2O = HO2– + 2 H+ + 2 e– ([OH–] = [HO2–])
H2O = H+ + OH– ([H+] = [OH–], pH = 7)
H– = H+ + 2 e– ([H–] = [H+])
H– + H2O = OH– + 2 H+ + 2 e– ([H–] = [OH–])

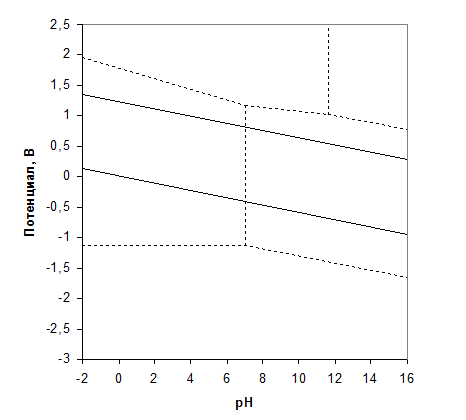
| Рис. 2.1. Диаграмма «потенциал – рН» для воды |
Пример. При электролизе растворов, содержащих хлорид-ионы, для окисления воды до кислорода необходим менее положительный анодный потенциал, чем для окисления хлорид-ионов до хлора:
Cl2 + 2 e– = 2 Cl– E0 = 1,36 В
½ O2 + 2 H+ + 2 e– = H2O ([H+] = 1 М) E0 = 1,23 В
Однако перенапряжение разряда кислорода на платиновом электроде составляет 0,4 – 0,5 В, тогда как перенапряжение окисления хлорид-ионов мало, поэтому на аноде будет протекать окисление хлоридов.
При электролитических разделениях основной катодной реакцией является восстановление иона металла до свободного металла:
Mn+ + ne– = M0(тв).
К другим распространенным реакциям относятся восстановление иона до ионной формы с меньшей степенью окисления и восстановление водорода: Fe3+ + e– = Fe2+
Cu2+ + e– + 3 Cl– = [CuCl3]–
H+ + e– = ½ H2 (газ)
Именно разряд водорода на катоде и ограничивает главным образом применение электроосаждения для аналитических определений.
Из кислого раствора без разряда водорода можно выделить лишь небольшое число металлов, имеющих положительный стандартный потенциал. Медь осаждают из растворов разбавленной азотной или серной кислоты, серебро – из цианидных или аммиачных растворов, никель и кобальт – из аммиачного раствора, цинк – из концентрированного раствора гидроксида натрия.
Последнее изменение этой страницы: 2016-07-23
lectmania.ru. Все права принадлежат авторам данных материалов. В случае нарушения авторского права напишите нам сюда...