
Категории:
ДомЗдоровьеЗоологияИнформатикаИскусствоИскусствоКомпьютерыКулинарияМаркетингМатематикаМедицинаМенеджментОбразованиеПедагогикаПитомцыПрограммированиеПроизводствоПромышленностьПсихологияРазноеРелигияСоциологияСпортСтатистикаТранспортФизикаФилософияФинансыХимияХоббиЭкологияЭкономикаЭлектроника
Жидкостная ионообменная хроматография
В основе ионообменной хроматографии лежит обратимый стехио-метрический обмен ионов между неподвижной твердой фазой – сорбентом и подвижной жидкой фазой – раствором, содержащим обмениваемые ионы.
3.3.1. Общая характеристика метода
В качестве сорбентов в ионообменной хроматографии используют иониты (ионообменники). Это нерастворимые в воде твердые вещества, состоящие из матрицы, в которой распределены ионогенные группы. Ионогенные группы включают фиксированные в матрице ионы и так называемые противоионы, которые менее прочно связаны с матрицей и поэтому способны отщепляться от ионита и переходить в раствор. Ионообменная хроматография основана на способности противоионов обмениваться с одноименными ионами раствора: катионы с катионами, анионы с анионами. Разделение смеси ионов осуществляется за счет их различной способности к ионному обмену с ионитом.
Иониты, обменивающиеся катионами раствора, называются катио-нитами (катионообменниками), а иониты, обменивающиеся анионами раствора, – анионитами (анионообменниками). Известны также амфотер-ные иониты (амфолиты), способные обмениваться с раствором как катио-нами, так и анионами.
Катионный обмен:

В рассматриваемом случае катионит в Н-форме (в Н+-форме, кислой форме) состоит из матрицы R (основа которой – органический полимер, полимерная смола) и ионогенной группы –SO3– H+. Отрицательно заряжен-ные группы –SO3– прочно связаны ковалентной связью с матрицей и в условиях ионного обмена отщепляться не могут. Напротив, противоионы – положительно заряженные катионы водорода Н+ – могут отщепляться от исходной ионогенной группы. Их замещают катионы металла М+, которые переходят из раствора в фазу сорбента и удерживаются в ионогенной группе –SO3– М+. В целом осуществляется катионный обмен, при котором катионы металла М+, ранее входившие в состав подвижной фазы – раство-ра, остаются на катионите, а катионы водорода Н+ переходят в раствор и уносятся подвижной фазой.
Анионный обмен:

Анионный обмен происходит аналогично. В рассматриваемом случае анионит в оснóвной форме, т.е. содержащей гидроксильные группы ОН–, состоит из матрицы R и ионогенной группы –N(CH3)3+OH–. Эта группа включает положительно заряженный катион –N(CH3)3+, прочно связанный в матрице ковалентной связью и не способный к отщеплению в условиях ионного обмена, и отрицательно заряженный противоион ОН–, который, напротив, способен к отщеплению от ионогенной группы и к обмену с анионами А– раствора. В результате такого обмена анионы А– переходят в ионогенную группу анионита и удерживаются в ней, а группы ОН–, перешедшие в раствор (подвижную фазу), уносятся вместе с нею.
3.3.2. Иониты
Иониты, применяемые в ионообменной хроматографии, могут быть неорганическими или органическими, природными или синтетическими. Наибольшее распространение получили синтетические ионообменные смолы, матрицы которых представляют собой продукты сополимеризации стирола с п-дивинилбензолом или поликонденсации фенола и его произ-водных с формальдегидом. Полимерные цепи в них связаны поперечными связями. Такие матрицы способны к набуханию в воде.
Сульфированием или другими реакциями в полученные полимерные матрицы вводят различные ионогенные группы. Хотя сами смолы нерас-творимы в воде, их активные группы гидрофильны и имеют различную степень сродства к ионам в растворе. Основные существующие типы ионообменных смол приведены в табл. 3.2.
Одним из наиболее важных показателей свойств ионитов является обменная емкость (ОЕ). Ее выражают количеством миллимолей эквива-лентов обменивающегося иона nэ, приходящихся на единицу массы воз-душно-сухого (в Н+-форме для катионита и Cl–- или ОН–-форме для анио-нита):
ОЕ = nэ / m(ионита), [ммоль экв/г],
или единицу объема набухшего ионита:
ОЕ = nэ / V(ионита), [ммоль экв/см3].
Обменная емкость определяется числом функциональных групп, способных к ионному обмену.
Различают полную и равновесную обменную емкость. Под полной обменной емкостью (ПОЕ) понимают максимальную способность ионита к ионному обмену в соответствии с концентрацией функциональных групп в полимере. Значение полной обменной емкости для данного образца ионита является постоянной величиной. Ее определяют по результатам потенциометрического титрования полимера, его элементного анализа и т.д. Процесс ионного обмена является равновесным, поэтому равновес-ное значение обменной емкости фиксируется в зависимости от ряда усло-вий процесса: концентрации раствора, рН среды, температуры, характера подачи раствора и т.д. Таким образом, значение равновесной обменной емкости не может быть постоянной величиной для данного ионита.
Таблица 3.2
Основные типы ионообменных смол
| Тип сорбента | Ионогенная группа | Подвижные ионы | Интервал рН обмена | Марка сорбента |
| Сильнокислотный катионит | –SO3H | H+ | 0 – 14 | КУ-1, КУ-2, СДВ |
| Среднекислотный катионит | –PO(OH)2 | H+ | 4 – 14 | КФ |
| Слабокислотный катионит | –COOH, –OH | H+ | 7 – 14 | КБ-2, КБ-4 |
| Сильноосновный анионит | –СН2N(CH3)3+Cl– | Cl– | 0 – 14 | АВ-17, АВ-18 |
| Слабоосновный анионит | –NH3+OH– | OH– | 0 – 7 | АН-23, АН-2Ф |
Примечание. КУ– катионит универсальный, СДВ – стиролдивинилбензол, КФ – катионит фосфоновокислый, КБ – катионит буферный, АВ – анионит высокоосновный, АН – анионит низкоосновный.
Существуют два основных метода определения обменной емкости ионитов: статический и динамический. Емкость, найденную в статичес-ких условиях, когда навеску смолы помещают в раствор насыщающего иона достаточной концентрации и выдерживают при встряхивании до полного насыщения, называют статической обменной емкостью (СОЕ). Величину емкости, полученную в динамических условиях при пропускании насыщающего раствора через колонку с ионитом, называют динамической обменной емкостью (ДОЕ). Последнюю определяют по количеству ионов, поглощенных к моменту появления («проскока») их в фильтрате в определенной концентрации. При полном обессоливании воды за «проскок» принимается концентрация, равная 1 г/см3. При очистке сточных вод концентрация ионов в момент «проскока» определяется пре-дельно допустимыми санитарными нормами. Полная динамическая обмен-ная емкость (ПДОЕ) находится по полному насыщению ионита данным видом ионов в проточном режиме, т.е. пока не установится равенство состава фильтрата и исходного раствора. Отношение ДОЕ/ПДОЕ < 1 определяется геометрическими характеристиками колонки, скоростью подачи раствора, его концентрацией и т.д.
При прочих равных условиях величина обменной емкости ионита сильно зависит от рН среды. Например, при рН ниже 7 слабокислотные смолы диссоциированы так мало, что обмен катионов практически не происходит. То же справедливо для слабоосновных смол при рН выше 7 (см. табл. 3.2).
Катиониты и аниониты характеризуются кажущимися значениями рК функциональных групп. Например, для сильнокислотных катионитов рК равны 1 – 2, среднекислотных – приблизительно 3 – 4, слабокислотных – рК > 5.
Для простейшего случая кислотно-основного обмена
RSO3H + Na+ ↔ RSO3Na + H+
зависимость обменной емкости от рН среды приблизительно описывается уравнением Гендерсона – Гассельбаха:
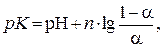
где рК – отрицательный десятичный логарифм кажущейся константы дис-социации ионита; n – постоянная, характеризующая степень структуриро-вания полимера; α – степень диссоциации ионогенных групп.
Величину α можно выразить как отношение CR / S, где CR – емкость при данном значении рН среды, ммоль экв/г; S – максимальная емкость ионита, ммоль экв/г. Тогда выражение для рК примет вид

После завершения ионного обмена и разделения ионов иониты мож-но регенерировать – снова перевести в исходное состояние, в котором они находились до начала проведения ионного обмена. Регенерация ионитов основана на обратимости и стехиометричности ионообменного процесса.
Катионит, перешедший в процессе ионного обмена из Н-формы в со-левую, можно снова превратить в исходное состояние путем промывания его достаточно концентрированным раствором кислоты по схеме
R–A– M+ + H+ = R–A– H+ + M+
Аналогично проводят регенерацию анионитов, например, по схеме
R–K+A– + OH– = R–K+OH– + A– (обработка раствором основания)
R–K+A– + Cl– = R–K+Cl– + A– (обработка раствором хлорида),
где К+ – связанный катион ионогенной группы; А– – обменивающийся анион.
Регенерация позволяет использовать ионообменные материалы многократно.
В общем случае иониты, применяемые в химическом анализе, должны быть химически устойчивыми в различных средах, механически прочными в сухом и особенно в набухшем состоянии, обладать большой обменной емкостью и полной обратимостью процессов обмена.
3.3.3. Ионообменное равновесие
Рассмотрим основные особенности ионообменного равновесия на примере катионного обмена. Пусть при катионном обмене протекает реакция:

Обменивающиеся катионы в фазе сорбента обозначены черточкой сверху, в растворе – только знаком «+».
Ионообменный процесс можно рассматривать как гетерогенную химическую реакцию между активными группами ионообменника и ионами в растворе, протекающую в соответствии с законом действия масс. Поскольку ионный обмен – это гетерогенное равновесие, то оно, как и любое химическое равновесие, подчиняется общим термодинамическим закономерностям, поэтому выражение для истинной термодинамической (т.е. выраженной через равновесные активности) константы KВ, А этого рав-новесия имеет вид
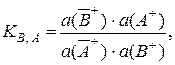 (3.1)
(3.1)
где все активности катионов равновесные.
Величина KВ, А называется константой ионного обмена. Для разбав-ленных растворов, когда коэффициенты активности ионов приблизительно равны единице, вместо формулы (3.1) можно составить выражение
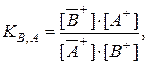 (3.2)
(3.2)
где все концентрации катионов равновесные.
Преобразуем формулу (3.2) к виду
 (3.3)
(3.3)
Из уравнения (3.3) следует, что отношение равновесных концентраций ионов в фазе сорбента прямо пропорционально отношению равновесных концентраций тех же ионов в растворе (рис. 3.2). Величина константы ионного обмена KВ, А определяется тангенсом угла наклона α прямой к оси абсцисс:
KВ, А = tgα.
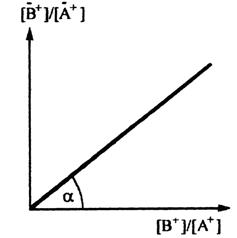
Рис. 3.2. График функции
Величина константы ионного обмена зависит от природы сорбента, жидкой фазы, обменивающихся ионов, их зарядового числа и является важнейшей характеристикой ионного обмена на данном сорбенте.
В случае ионного обмена с участием многозарядных ионов величину KВ, А определяют по более общему уравнению изотермы Никольского, част-ным случаем которого является уравнение (3.1):

где zA и zB – зарядовые числа ионов А и В.
Если KВ, А = 1, то сродство катионов А и В к иониту одинаково: ион-ный обмен практически не происходит.
Если KВ, А > 1, то равновесие ионного обмена смещено вправо: проис-ходит обмен ионов вида В на ионы А.
Если KВ, А < 1, то равновесие ионного обмена смещено влево.
Аналогично можно провести рассмотрение ионного обмена и в слу-чае анионитов.
Сродство ионов к сорбенту зависит от многих факторов – радиуса и заряда (зарядового числа) ионов, их поляризуемости и т.д. Наиболее об-щим комплексным фактором, влияющим на сорбируемость ионов, является объем иона в гидратированном состоянии: чем он меньше, тем сорбируемость иона выше.
Установлены ряды сорбируемости ионов на ионообменниках.
Для катионитов в основном характерны следующие последователь-ности сорбируемости катионов:
Li+ < H+ < Na+ < K+ < NH4+ < Rb+ < Cs+ < Ag+ < Tl+
Hg2+ < Cd2+ < Mn2+ < Mg2+ < Zn2+ < Cu2+ < Ni2+ < Co2+ < Ca2+ < Sr2+ < Pb2+ < Ba2+
Al3+ < Sc3+ < < Y3+ < Eu3+ < Sm3+ < Nd3+ < Ce3+ < La3+
Наименьшим сродством к катиониту обладают катионы лития и во-дорода, наибольшим – катионы лантана.
Аналогичные ряды сорбируемости известны и для анионов.
Ряды последовательной сорбируемости ионов могут несколько изме-няться в зависимости от природы ионита и условий проведения ионного обмена.
Если в жидкой подвижной фазе, контактирующей с катионообмен-ником, имеются два типа катионов – В+ и С+, способные обмениваться с катионами А+ сорбента, то в соответствии с формулой (3.2) можно соста-вить два выражения для констант ионного обмена – KВ, А и KC, А:
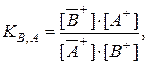
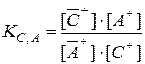
Отношение КВ,А / КС,А обозначают как αB / C :
αB / C 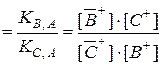
Величину αB / C называют фактором (коэффициентом) разделения ионов В+ и С+, или коэффициентом селективности. Он характеризует способ-ность данного ионита к разделению смеси двух ионов, находящихся в растворе. Если αB / C = 1, то разделения ионов не происходит.
Аналогичные результаты можно получить и для разделения двух анионов.
Для наиболее эффективного разделения ионов методом ионообмен-ной хроматографии следует подбирать иониты с высоким фактором разде-ления.
Способность ионита к обмену и сорбции ионов количественно харак-теризует коэффициент распределения Kр, рассчитываемый по формуле:
Kр = g1 / g2,
где g1 = n1/m; g2 = n2/V; n1 – количество ионов, сорбированных иони-том массой m (в пересчете на сухое вещество, в граммах) из раствора объемом V (см3), содержащего при равновесии количество n2 тех же ионов.
3.3.4. Определение коэффициентов распределения ионов Cd2+ и Zn2+ на катионите (работа № 20)
Цель работы: определение коэффициентов распределения; исследо-вание влияния на них кислотности раствора и условий ионообменного разделения.
Сущность метода. Для нахождения оптимальных условий хромато-графического разделения элементов обычно определяют сорбцию элемен-тов ионообменными смолами из растворов. Из применяемых в хромато-графии методов определения сорбционной способности элемента наиболее простым является метод определения коэффициентов распределения элемента между ионообменной смолой и раствором.
В данной работе коэффициент распределения Kр определяют путем приведения в равновесие точной навески воздушно-сухой смолы массой mс с определенным объемом исследуемого раствора V, содержащим металл массой mисх. После установления равновесия в аликвотной части раствора химическими методами определяют количество непоглощенного смолой металла mост. При этом масса металла, перешедшего в твердую фазу, может быть найдена как (mисх – mост). Вычисление Kр проводят по формуле
 (3.4)
(3.4)
где mс – масса ионообменной смолы, г; mисх – масса элемента в исходном растворе, мг; mост – масса элемента в конечном растворе, мг; V – объем раствора, см3.
Формула (3.4) является следствием более общего соотношения для межфазного равновесия:
 (3.5)
(3.5)
где C1 и С2 – концентрации вещества в смежных фазах.
Оборудование: 1) механический встряхиватель; 2) колбы коничес-кие на 100 см3 с пробками – 6 шт.; 3) колбы конические на 100 см3 для титрования – 6 шт.; 4) пипетки на 10 см3 – 6 шт.; 5) мерный цилиндр на 25 см3 (для соляной кислоты) – 1 шт.
Реактивы: 1) стандартный раствор с концентрацией ионов Zn2+ 1 мг/см3; 2) стандартный раствор с концентрацией ионов Cd2+ 1 мг/см3; 3) 0,05; 0,2 и 0,5 М растворы соляной кислоты; 4) катионит КУ-1 в Н+-форме (воздушно-сухой); 5) аммиачный буфер (рН=10); 6) индикатор эриохром черный Т; 7) 0,25 н. раствор трилона Б (динатриевой соли N,N,N’,N’-этилендиаминтетрауксусной кислоты).
Ход работы. В три конические колбы емкостью 100 см3 отмерить пипеткой по 10 см3 стандартного раствора цинка с концентрацией 1 мг/см3, затем цилиндром – по 15 см3 соответственно 0,05; 0,2 и 0,5 М раствора НСl. В каждую колбу внести по 0,20 г (взвешивать на технических весах) катионита КУ-l в Н+-форме. Таким же образом приготовить три колбы с раствором кадмия. Все колбы закрыть и поставить на механический встряхиватель на 1,5 ч.
После встряхивания из каждой колбы последовательно отбирать по две параллельные пробы объемом 10,0 см3 в колбы для титрования. Затем добавить в них по 10 см3 воды, 5 см3 аммиачного буфера, на кончике шпа-теля индикатора эриохрома черного Т. Оттитровать содержимое каждой колбы раствором трилоном Б до перехода окраски из красно-фиолетовой через сине-фиолетовую в синюю (для обоих видов ионов).
Средние результаты по каждой паре параллельных титрований занести в табл. 3.3. Произвести необходимые расчеты и заполнить таблицу.
Таблица 3.3
Определение коэффициентов распределения ионов Zn2+ и Cd2+
| № про-бы | Ме-талл | Концентрация раствора HCl с учетом разбавления, моль/дм3 | Средний объем раствора трилона Б, см3 | Масса ионов в исходном растворе mисх, мг | Масса ионов в оставшемся растворе mост, мг | Масса ионов, поглощенных смолой (mисх – mост), мг | Kр |
| Zn | |||||||
| Cd | |||||||
1. Произвести пересчет концентрации растворов HCl с учетом раз-бавления проб раствором соли металла (Сист):
Cист = Сисх · 15 / 25,
где Cисх – концентрация раствора HCl до разбавления (0,05; 0,2 и 0,5 моль/дм3); 15 – объем раствора HCl до разбавления, см3; 25 – объем раствора HCl после разбавления, см3.
2. Рассчитать массу металла mост, не поглощенного смолой и оставшегося в растворе, учитывая, что 1 см3 0,25 н. раствора трилона Б соответствует 0,008173 г цинка или 0,01405 г кадмия:
ТТр.Б/Zn = 0,008173 г/см3, ТТр.Б/Cd = 0,01405 г/см3.
mост(Ме) = ТТр.Б/Ме · V(Тр.Б).
3. По формуле (3.4) вычислить коэффициент распределения Kр.
4. Для каждого из металлов построить график зависимости коэффи-циента распределения от концентрации HCl в растворе (Сист). Объяснить наблюдаемую закономерность.
5. Сделать выводы об оптимальных условиях сорбции ионов цинка и кадмия на катионите КУ-1 в Н+-форме.
6. Высказать мнение о возможности разделения этих металлов, рас-считав коэффициент разделения, равный отношению значений Kр в одина-ковых условиях.
Контрольные вопросы
1. Обменная емкость ионита и способы ее определения.
2. Ионообменное равновесие. Уравнение Никольского.
3. Типы ионообменных смол. Функциональные группы ионитов.
4. Коэффициенты распределения и разделения.
5. Как и почему изменяется величина Kр по мере увеличения кислот-ности раствора?
Литература
Ольшанова, К.М. Практикум по хроматографическому анализу / К.М. Ольшанова. М.: Высш. школа, 1970. 312 с.
3.3.5. Разделение смеси ионов свинца и меди (работа № 21)
Цель работы: изучить основы метода разделения ионов в ионооб-менной колонке; провести количественный анализ компонентов разделя-емой смеси.
Сущность метода. Разделение ионов Pb2+ и Cu2+ основано на получении комплексных ионов [Pb(H2C4O6)]2– и Cu[(NH3)4]2+. Аммиачный комплекс меди прочнее тартратного; для свинца наблюдается обратная зависимость. Поэтому катионит сорбирует комплексные катионы меди, а анионные тартратные комплексы свинца проходят через колонку.
Оборудование: 1) ионообменная колонка; 2) мерные колбы на 200 и 250 см3; 3) пипетки на 5, 10 и 50 см3; 4) стаканы на 100 и 300 см3; 5) мерные цилиндры на 25 или 50 см3 – 2 шт.; 6) бюретка на 50 см3; 7) колбы конические для титрования; 8) стеклянная палочка.
Реактивы: 1) 0,5 М раствор нитрата меди (II); 2) 0,2 М раствор нит-рата свинца (II); 3) концентрированный и 1 М растворы аммиака; 4) 1 М раствор хлорида аммония; 5) кислота винная кристаллическая; 6) 0,5 М раствор дихромата калия; 7) 2 М раствор соляной кислоты; 8) катионит КУ-2 в Н+-форме; 9) 0,05 М раствор трилона Б; 10) свежий насыщенный водный раствор индикатора мурексида; 11) раствор индикатора эриохрома черного Т (0,2 г в 50 см3 этанола); 12) 0,5 М раствор K4[Fe(CN)6].
Ход работы. В стакан объемом 100 см3 с полученной у инженера лаборатории задачей, содержащей по 4 – 7 см3 рабочих растворов Pb(NO3)2 и Cu(NO3)2, добавить 5 г винной кислоты. После полного растворения кис-лоты отмерить цилиндром и прилить в стакан 20 см3 раствора аммиака. Полученный раствор пропустить через колонку с 15 г катионита КУ-2 в Н+-форме со скоростью 2 капли в секунду.
Растворить в 180 см3 воды 6 г винной кислоты, прилить в этот рас-твор 20 см3 концентрированного раствора аммиака и перемешать. Приго-товленным раствором порциями по 10 – 15 cм3 вымыть сорбированные на смоле ионы свинца. Промывку прекращают, как только проба с дихрома-том калия перестанет показывать наличие ионов свинца:
Pb2+ + CrO42– = PbCrO4↓
Раствор, вытекающий из колонки, собрать в мерную колбу объемом 250 см3 и довести содержимое колбы до метки дистиллированной водой.
После вымывания свинца смолу промывают порцией воды объемом 20 см3. Затем приступают к промывке колонки раствором соляной кислоты (10 порций по 15 см3). Вытекающий раствор собирают в мерную колбу объемом 200 см3. Элюирование прекращают после исчезновения ионов ме-ди в растворе на выходе из колонки, о чем судят по реакции с K4[Fe(CN)6]:
2 Сu2+ + [Fe(CN)6]4– = Cu2[Fe(CN)6]↓
Доводят объем до метки водой и анализируют содержание в нем ионов меди.
Титрование ионов свинца раствором трилона Б
Отобрать пипеткой пробу раствора объемом 50 см3 и разбавить ее водой до 100 см3. На 100 см3 анализируемого раствора прибавить 1 г винной кислоты и 10 см3 концентрированного раствора аммиака. Получен-ную систему нагреть до 70 – 80 °С, прибавить 7 – 8 капель раствора инди-катора эриохрома черного Т и титровать раствором трилона Б до перехода окраски из розовой в синюю.
Титрование ионов меди раствором трилона Б
К пробе раствора объемом 50 см3 прибавить воды до 100 см3, а затем 1 М раствор аммиака до рН = 8. Затем прибавить 10 см3 раствора NH4Cl и 7 – 8 капель раствора мурексида. Оттитровать полученную систему раство-ром трилона Б до перехода окраски из желтой в фиолетовую.
По результатам титрования определить массу свинца и меди в элю-ате по формуле
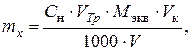 (3.6)
(3.6)
где Сн – нормальность раствора трилона Б; VТр – средний объем раствора трилона Б, пошедший на титрование, см3; Vк – объем мерной колбы (250 или 200 см3); V – объем аликвоты раствора (50 см3); Mэкв – молярная масса эквивалента соответствующего металла, г/моль.
Для каждого металла вычислить отношение массы в элюате к массе в пробе, выданной инженером лаборатории. Результат выразить в процентах. Сделать вывод о возможности использования метода ионного обмена для разделения катионов металлов.
Контрольные вопросы
1. Ионообменная хроматография. Виды ионитов, их строение.
2. Статическая и динамическая обменная емкость ионита. Выходная кривая сорбции.
3. Коэффициент распределения. Коэффициент разделения.
4. Константа ионного обмена. Уравнение Никольского.
5. Секционные ряды сродства.
6. Области применения ионообменного разделения.
7. Опишите химизм процессов, протекающих при выполнении работы.
3.3.6. Разделение смеси ионов меди и цинка на катионите КУ-2 (работа № 22)
Цель работы: изучить основы метода разделения ионов в ионооб-менной колонке; провести количественный анализ компонентов разделя-емой смеси.
Сущность метода. Ионы меди и цинка образуют комплексные со-единения с оксалат-ионом с различными константами нестойкости. Если колонку, на катионит которой предварительно нанесен раствор, содержа-щий катионы меди и цинка, промыть раствором оксалата аммония, более стойкий комплексный анион меди перейдет в раствор, а ионы цинка останутся связанными с катионитом. Поэтому при промывании слоя катионита раствором оксалата аммония в фильтрате можно обнаружить только медь. После промывания колонки раствором соляной кислоты ионы цинка вследствие десорбции будут переведены во второй фильтрат.
Оборудование:1) хроматографическая колонка длиной 15 см и диа-метром 1,0 – 1,2 см; 2) колбы конические на 250 см3 – 2 шт.; 3) стаканы на 100 и 250 см3 – 2 шт.; 4) бюретки на 5 см3.
Реактивы:1) 0,1 н. раствор соли цинка; 2) 0,1 н. раствор соли меди; 3) 3 н. раствор соляной кислоты; 4) 0,25 н. раствор оксалата аммония; 5) раствор пероксида водорода с массовой долей Н2О2 6%; 6) раствор аммиака с массовой долей NH3 25%; 7) 0,1 н. раствор трилона Б; 8) мурек-сид, твердая смесь с хлоридом натрия (1:100); 9) эриохром черный Т, твердая смесь с хлоридом натрия (1:100); 10) хлорид аммония, х.ч.; 11) индикатор метиловый оранжевый.
Ход работы. Полученную у инженера лаборатории задачу – раствор (4 – 5 см3), содержащий медь и цинк, – вливают в колонку. Затем колонку с катионитом промывают водой до нейтральной реакции по метиловому оранжевому и вводят в нее 40 – 60 см3 0,25 н. раствора оксалата аммония.
Вследствие перехода меди в комплекс, вся содержащаяся на катио-ните медь вымывается в фильтрат. Последний при нагревании обрабатыва-ют 6%-ным раствором пероксида водорода (6 – 7 капель) в течение 10 мин. После охлаждения добавляют раствор аммиака до образования медно-аммиачного комплекса (синее окрашивание). Полноту вымывания меди из колонки проверяют обработкой порций фильтрата пероксидом при нагре-вании с последующим добавлением после охлаждения раствора аммиака. Отсутствие синего окрашивания указывает на полноту вымывания меди. При наличии синего окрашивания фильтрата его приливают к основной массе фильтрата и продолжают промывать колонку раствором оксалата аммония до полного удаления меди.
Весь фильтрат после обработки пероксидом водорода и аммиаком титруют 0,1 н. раствором трилона Б в присутствии мурексида. После до-бавления мурексида раствор становится желтым или коричневым, что зависит от количества индикатора, а также от концентрации ионов меди. В точке эквивалентности окраска резко переходит в фиолетовую. По количеству пошедшего на титрование раствора трилона Б по формуле (3.6) рассчитывают содержание ионов меди в растворе.
Оставшийся на катионите цинк удаляют промыванием 3 н. раство-ром HCl. Расход кислоты составляет примерно 50 – 60 см3. К фильтрату добавляют избыток раствора аммиака (36 – 40 см3) и 5,5 – 6,5 г хлорида аммония с таким расчетом, чтобы получить буферный раствор, необходи-мый для определения цинка. Полученную смесь разбавляют дистиллиро-ванной водой до 100 см3 и титруют 0,1 н. раствором трилона Б в присут-ствии индикатора эриохрома черного Т до перехода винно-красной окрас-ки в синюю. По объему раствора трилона Б, пошедшего на титрование, по формуле (3.6) рассчитывают содержание цинка в исходном растворе.
После вымывания цинка 3 н. раствором HCl колонку промывают дистиллированной водой до отсутствия кислой реакции по метиловому оранжевому. В процессе работы необходимо следить за тем, чтобы хрома-тографическая колонка не имела пустот. По окончании работы следует заполнить колонку водой.
Контрольные вопросы
1. В чем сущность ионообменной хроматографии?
2. Как определяют: а) статическую обменную емкость ионита; б) ди-намическую обменную емкость ионита?
3. Опишите химизм процессов, протекающих при выполнении работы.
4. Ряды сорбируемости ионов на ионообменниках. Какую информа-цию они несут?
5. Что характеризуют: а) константа ионного обмена; б) коэффициент селективности; в) коэффициент разделения?
6. Каковы области применения достоинства и недостатки ионообмен-ной хроматографии?
Литература
1. Зубакова, Л.Б. Синтетические ионообменные материалы / Л.Б. Зубакова, А.С. Тевлина, А.Б. Даванков. М.: Химия, 1978. 184 с.
2. Мархол, М. Ионообменники в аналитической химии: в 2-х ч. / М. Мархол. М.: Мир, 1985.
3.3.7. Разделение меди и цинка на анионите ЭДЭ-10П (работа № 23)
Цель работы: изучить основы метода разделения ионов в ионооб-менной колонке; провести количественный анализ компонентов разделя-емой смеси.
Сущность метода. Разделение ионов меди и цинка основано на том, что ионы цинка образуют в 3 М растворе соляной кислоты комплексный анион [ZnCl3]–, а катионы меди такого иона не образуют. Таким образом, при пропускании через слой анионита 3 М раствора HCl, содержащего смесь ионов цинка и меди, первый ион будет задержан на колонке с анио-нитом, а ион меди пройдет через нее свободно:
RCl + [ZnCl3]– ® R[ZnCl3] + Cl–
При дальнейшей промывке колонки водой происходит разрушение комплексного аниона; цинк принимает форму катиона и смолой не задер-живается.
Оборудование: 1) хроматографическая колонка длиной 15 см и диа-метром 1,0 – 1,2 см; 2) колбы конические на 250 см3 – 3 шт.; 3) мерный цилиндр на 250 см3 – 1 шт.; 4) мерные пипетки на 25 см3 – 2 шт.; 5) мер-ные колбы на 250 см3 – 2 шт.
Реактивы: 1) аммиачный буферный раствор (рН = 9,2); 2) 3 М рас-твор соляной кислоты; 3) водный раствор аммиака с массовой долей NH3 10%; 4) 0,025 н. раствор трилона Б; 5) мурексид; 6) эриохром черный Т.
Ход работы. Через хроматографическую колонку пропускают 25 см3 3 М раствора соляной кислоты. К контрольной задаче добавляют 5 см3 3 М раствора HCl и пропускают через колонку со скоростью 1 капля в секунду, собирая раствор в мерную колбу на 250 см3. Затем колонку промывают 100 см3 раствора HCl и собирают элюат в ту же колбу. Здесь будет содержаться медь, отделенная от цинка. После этого через колонку пропускают 150 см3 воды и собирают элюат, содержащий цинк, в другую мерную колбу на 250 см3.
Содержимое обеих колб доводят до метки дистиллированной водой и перемешивают.
Определение меди
Аликвотную часть раствора объемом 25 см3 отбирают пипеткой и переносят в коническую колбу на 250 см3. Нейтрализуют 10%-ным раствором аммиака до появления синей окраски аммиачного комплекса меди, затем добавляют еще 2 капли раствора аммиака, индикатор мурексид и титруют 0,025 н. раствором трилона Б до перехода окраски из желтой в красно-фиолетовую.
Определение цинка
Пробу раствора объемом 25 см3 отбирают пипеткой в колбу на 250 см3, добавляют 30 см3 воды и 10 см3 аммиачного буфера. Содержимое колбы подогревают до 60 – 70 оС, добавляют индикатор эриохром черный Т и титруют до перехода окраски из красно-фиолетовой в синюю.
Расчет массы цинка и меди mx проводят по формуле (3.6).
Хроматографическая колонка всегда должна быть заполнена рас-твором. Нельзя допускать наличия в ней пузырьков воздуха. После работы обязательно заполните колонку водой.
Контрольные вопросы
1. В чем сущность ионообменной хроматографии?
2. Опишите химизм процессов, протекающих при выполнении работы.
3. Какие неподвижные фазы используют в ионообменной хромато-графии для разделения анионов и катионов?
4. Какие выводы можно сделать на основании кривых титрования ионообменников, какие их характеристики определить?
5. Чем определяется рабочий интервал рН для катионитов и аниони-тов разных видов?
6. Что такое обменная емкость ионообменников?
7. От чего зависит сродство ионов к иониту?
8. Что характеризуют: а) константа ионного обмена; б) коэффициент селективности; в) коэффициент разделения?
9. Каковы области применения достоинства и недостатки ионообмен-ной хроматографии?
Последнее изменение этой страницы: 2016-07-23
lectmania.ru. Все права принадлежат авторам данных материалов. В случае нарушения авторского права напишите нам сюда...