
Категории:
ДомЗдоровьеЗоологияИнформатикаИскусствоИскусствоКомпьютерыКулинарияМаркетингМатематикаМедицинаМенеджментОбразованиеПедагогикаПитомцыПрограммированиеПроизводствоПромышленностьПсихологияРазноеРелигияСоциологияСпортСтатистикаТранспортФизикаФилософияФинансыХимияХоббиЭкологияЭкономикаЭлектроника
Определение концентрации серной кислоты и сульфата меди методом кондуктометрического титрования (работа № 17)
Цель работы: изучение метода кондуктометрического титрования; определение количества серной кислоты и сульфата меди в растворе.
Сущность метода. Способность проводить электрический ток является одним из важнейших физико-химических свойств водных растворов электролитов. Электропроводность растворов зависит от концентрации и природы присутствующих заряженных частиц, поэтому измерение электропроводности может быть использовано для количест-венного определения химического состава раствора.
Оборудование: 1) кондуктометр ОК-102/1; 2) магнитная мешалка; 3) ячейка для титрования (стакан на 300 см3); 4) три бюретки (для раство-ров H2SO4, CuSO4 и NaOH); 5) цилиндр на 300 см3 – 2 шт.; 6) промывалка; 7) кристаллизатор; 8) штатив для бюреток.
Реактивы: 1) 0,01 н. раствор гидроксида натрия; 2) 0,01 н. раствор сульфата меди; 3) 0,0100 н. раствор серной кислоты (из фиксанала).
Ход работы. Приготовление раствора гидроксида натрия и его стандартизация. Взвешивают на технических весах 0,2 г NaOH и раство-ряют в 0,5 дм3 воды. Полученный ~0,01 н. раствор заливают в бюретку. Его точную концентрацию устанавливают кондуктометрическим титрованием.
В ячейку отмеряют пипеткой 5,00 см3 0,0100 н. раствора H2SO4, доливают дистиллированную воду, чтобы отверстия на электроде были погружены в раствор. Включают магнитную мешалку и через 1 – 2 мин проводят измерение начальной электропроводности раствора. Содержимое ячейки титруют раствором NaOH порциями по 0,5 см3. После прибавления каждой порции перед измерением электропроводности следует выждать 1 – 2 мин. Первое титрование можно провести с повышенной скоростью, приливая по 1 см3 титранта. При последующих титрованиях вблизи точки эквивалентности порции титранта уменьшают до 0,5 см3. После точки излома определяют электропроводность еще в 4 – 5 точках. Титрование повторяют до получения трех сходящихся (т.е. отличающихся не более чем на 0,1 см3) результатов. Полученные данные заносят в табл. 2.6.
Таблица 2.6
Титрование раствора серной кислоты кондуктометрическим методом (V(H2SO4) = 5,00 см3; Сн(H2SO4) = 0,0100 моль/дм3)
| Титрование 1 | Титрование 2 | Титрование 3 | |||
| V(NaOH), см3 | 1/R, Ом –1 | V(NaOH), см3 | 1/R, Ом –1 | V(NaOH), см3 | 1/R, Ом –1 |
| … | … | … | … | … | … |
Строят график зависимости электропроводности от объема раствора NaOH (рис. 2.16). По резкому перегибу на кривой находят точку эквива-лентности, определяют эквивалентный объем титранта Vэкв(NaOH).

Рис. 2.16. Зависимость электропроводности раствора серной кислоты от объема прилитого раствора гидроксида натрия
Из трех параллельных определений находят среднее значение экви-валентного объема раствора гидроксида натрия 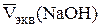 и рассчитыва-ют концентрацию NaOH с точностью до четырех значащих цифр:
и рассчитыва-ют концентрацию NaOH с точностью до четырех значащих цифр:
 .
.
Определение концентрации раствора сульфата меди. В ячейку от-меряют из бюретки 5,00 см3 раствора сульфата меди и доливают дистилли-рованную воду до полного погружения отверстий на электроде в раствор. Содержимое ячейки титруют раствором гидроксида натрия, концентрация которого теперь известна, порциями по 0,5 см3. Анализ выполняется так же, как титрование раствора серной кислоты. Определение повторяют до получения трех сходящихся результатов. Полученные данные заносят в таблицу, аналогичную табл. 2.6. Вычерчивают кривую кондуктометричес-кого титрования (рис. 2.17), по графику определяют точку эквивалент-ности. По трем параллельным определениям находят среднее значение эквивалентного объема раствора гидроксида натрия 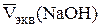 и концен-трацию раствора сульфата меди с точностью до четырех значащих цифр:
и концен-трацию раствора сульфата меди с точностью до четырех значащих цифр:
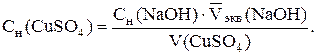

Рис. 2.17. Зависимость электропроводности раствора сульфата меди от объема прилитого раствора гидроксида натрия
Учебная задача. Для проверки правильности работы выполнить титрование смеси известного состава. В ячейку отбирают из бюретки произвольные объемы растворов серной кислоты и сульфата меди. Значения записывают в тетрадь (например, 4,30 см3 раствора H2SO4 и 6,50 см3 раствора CuSO4). Приготовленную смесь титруют раствором NaOH до получения трех сходящихся результатов. Полученные данные заносят в табл. 2.7.
Таблица 2.7
Титрование раствора серной кислоты и сульфата меди кондуктометрическим методом
(V(H2SO4) = 4,30 см3; V(CuSO4) = 6,50 см3;
Сн(H2SO4) = 0,0100 моль/дм3; Сн(CuSO4) = … моль/дм3)
| Титрование 1 | Титрование 2 | Титрование 3 | |||
| V(NaOH), см3 | 1/R, Ом –1 | V(NaOH), см3 | 1/R, Ом –1 | V(NaOH), см3 | 1/R, Ом –1 |
| … | … | … | … | … | … |
Вычерчивают кривую кондуктометрического титрования (рис. 2.18). По графику определяют две точки эквивалентности. По трем параллель-ным определениям находят средние значения эквивалентных объемов раствора гидроксида натрия, израсходованные на титрование соответ-ственно H2SO4 V1(NaOH) и CuSO4 V2(NaOH).

Рис. 2.18. Кривая кондуктометрического титрования
раствора серной кислоты и сульфата меди
Поскольку до первой точки эквивалентности титруется только серная кислота, то
V1(NaOH) = Vэкв1
После первой точки эквивалентности c гидроксидом натрия реагирует сульфат меди, поэтому
V2(NaOH) = Vэкв2 – Vэкв1
Рассчитывают исходные объемы растворов серной кислоты и сульфата меди с точностью до четырех значащих цифр:


Если экспериментально найденные значения объемов растворов H2SO4 и CuSO4 совпадают с исходными (допустима относительная ошибка 0,2 – 0,3%), то можно приступить к контрольной задаче.
Контрольная задача. Исследуемый раствор количественно перено-сят в ячейку, добавляют воду и титруют точно так же, как в учебной задаче. Заполняют таблицу, аналогичную табл. 2.7. Строят график зависи-мости электропроводности от объема прилитого раствора гидроксида натрия. Находят точки эквивалентности и рассчитывают объемы растворов серной кислоты и сульфата меди, взятых для приготовления задачи.
Вычисляют массы серной кислоты и сульфата меди в задаче:
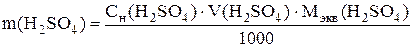 ;
;
 ,
,
где Мэкв(H2SO4) и Mэкв(CuSO4) – молярные массы эквивалентов соответ-ственно серной кислоты и сульфата меди, г/моль (фактор эквивалентности для каждого из веществ равен ½). По результатам трех параллельных определений рассчитать среднеквадратичную ошибку и доверительный интервал для полученных величин (доверительная вероятность 95%).
Порядок работы на кондуктометре ОК-102/1 (см. с. 94).
Задание
1. Построить кривые титрования, найти точки эквивалентности, определить для каждого титрования эквивалентные объемы (см. приложе-ние 3).
2. Рассчитать концентрацию раствора гидроксида натрия.
3. Рассчитать концентрацию раствора сульфата меди.
4. Определить объемы стандартных растворов серной кислоты и суль-фата меди в контрольной задаче.
5. Вычислить массу H2SO4 и CuSO4 в контрольной задаче.
6. При наличии нескольких параллельных измерений проводят ста-тистическую обработку результатов анализа: рассчитывают среднее арифметическое значение, среднеквадратичную ошибку, доверительный интервал, относительную ошибку определения (см. приложение 2).
Контрольные вопросы (см. также вопросы к работе № 16).
1. Можно ли по виду кривых кондуктометрического титрования с участием сильной кислоты и сильного основания, записанных для одних и тех же растворов в одинаковых условиях, определить порядок сливания реагентов?
2. Объясните ход кривой кондуктометрического титрования смеси ионов Ni2+ и Са2+ раствором этилендиаминтетрауксусной кислоты (ЭДТА). Как по кривой титрования определить объемы раствора ЭДТА, необходи-мые для расчета концентрации ионов никеля и кальция?
3. Обсудите влияние разбавления титруемого раствора титрантом на результаты химического анализа, проведенного методом кондуктометри-ческого титрования.
Литература
1. Худякова, Т.А. Теория и практика кондуктометрического и хро-нокондуктометрического анализа / Т.А. Худякова, А.П. Крешков. М., 1976.
2. Грилихес, М.С. Кондуктометрия, контактная кондуктометрия / М.С. Грилихес, Б. Филановский. Л., 1980.
Полярографический анализ
Полярография представляет собой разновидность вольтамперомет-рии – группы электрохимических методов, в которых регистрируют силу тока в зависимости от потенциала рабочего (индикаторного) электрода.
В зависимости от вида развертки потенциала и механизма массопереноса различают вольтамперометрию с линейной разверткой потенциала (вольтамперометрию при постоянном токе), методы со ступенчатым изменением потенциала, гидродинамические методы и инверсионную вольтамперометрию.
Вольтамперометрические методы представляют собой точные методы определения многих органических и неорганических веществ (в основном, ионов металлов), которые можно электрохимически окислить или восстановить (электроактивные вещества) в следовых количествах. С помощью вольтамперометрии возможно одновременное определение нескольких веществ. Если рабочий электрод является микроэлектродом, объем анализируемого раствора сравнительно велик, а время анализа мало, концентрация определяемого вещества в объеме раствора во время анализа изменяется незначительно. Вольтамперометрические методы умеренно селективны, но селективность можно значительно повысить, например, сочетанием жидкостной хроматографии с электрохимическим детектированием.
Термин полярография относится только к вольтамперометрии с использованием ртутного капающего электрода.
Вольтамперометрическая ячейка состоит из анализируемого раствора, двух электродов разного размера и электрода сравнения. Микроэлектрод является индикаторным электродом, в то время как другой токопроводящий электрод служит вспомогательным или противоэлектро-дом. Потенциостат контролирует напряжение между индикаторным электродом и вспомогательным электродом, поддерживая разность потенциалов между индикаторным электродом и электродом сравнения в соответствии с заранее выбранной разверткой напряжения, обеспечиваемой программатором (или микрокомпьютером). Разность потенциалов между индикаторным электродом и электродом сравнения измеряют высокоомным контуром обратной связи (ток в нем отсутствует). Потенциостат считается «активным инструментом», который извне контролирует потенциал индикаторного электрода. На рис. 2.19 показана схема установки для работы при контролируемом потенциале. Для вольтамперометрического анализа водных растворов можно использовать более простую двухэлектродную схему (индикаторный электрод и электрод сравнения).

Рис. 2.19. Принципиальная схема полярографа: а – ртутный капающий электрод (РКЭ); б – двухэлектродная полярографическая ячейка; в – трехэлектродная полярографическая ячейка (РКЭ – ртутный капающий электрод, ВЭ – вспомогательный электрод, ЭС – электрод сравнения)
Индикаторный электрод – идеально поляризуемый электрод, т.е. электрод, характеризующийся большим сдвигом потенциала при протекании бесконечно малого тока. Поляризация электрода отвечает горизонтальному участку на кривой i – E электрода и определяет диапазон потенциалов, пригодный для аналитических целей, поскольку в нем можно изучать процессы электрохимического окисления или восстановления определяемого вещества. Напротив, идеально неполяризуемый электрод – это электрод с фиксированным потенциалом, не изменяющимся при протекании относительно небольших токов. Неполяризуемые электроды, такие как электроды второго рода или электрод из донной ртути с большой поверхностью, используют в вольтамперометрии в качестве электродов сравнения. Вспомогательным электродом (токопроводящим противоэлек-тродом) может служить, например, платиновая проволока.
В вольтамперометрии используют различные индикаторные электроды; наиболее часто применяемые электроды обсуждаются ниже.
Ртутный капающий электрод. В классической полярографии инди-каторным электродом является ртутный капающий микроэлектрод. Ртут-ная капля образуется на конце стеклянного капилляра (длиной 10 – 20 см, внутренним диаметром 0,05 мм), соединенного гибкой трубкой с резер-вуаром со ртутью (рис. 2.19а). Ртутные капли имеют воспроизводимый диаметр и время жизни от 2 до 6 с. Время жизни капли зависит от высоты столба ртути над капилляром, т.е. гидростатического давления ртути. Иногда используют механический молоточек, контролирующий время жизни капель.
Ртутный капающий электрод обладает следующими преимущества-ми: 1) постоянное обновление поверхности электрода предотвращает ее загрязнение, что выражается в высокой воспроизводимости зависимостей ток – потенциал; 2) перенапряжение водорода на ртути в водных растворах велико, поэтому можно изучать процессы восстановления электроактив-ных веществ с более отрицательными потенциалами, чем обратимый потенциал разряда ионов водорода. В кислом растворе, например в 0,1 М НС1, выделение газообразного водорода наблюдается при потенциалах отрицательнее –1,2 В; 3) ртуть образует амальгамы со многими металлами, понижая их потенциал восстановления.
Интервал поляризации ртутного электрода в водном растворе при от-сутствии кислорода составляет (относительно насыщенного каломельного электрода) от +0,3 примерно до –2,7 В. В катодной области он ограничен потенциалами восстановления катионов фонового электролита, который добавляют для обеспечения диффузионного массопереноса. Наиболее отрицательных потенциалов можно достичь, применяя соли тетраалкил-аммония. Окисление ртути
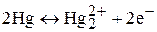
ограничивает интервал поляризации в анодной области потенциалов. На ртутном микроэлектроде в основном можно определять восстанав-ливающиеся электроактивные вещества.
Твердые электроды. Для определения окисляющихся веществ обычно используют твердые электроды. Из твердых электродов, используемых при электролизе (платиновых, золотых, графитовых), в аналитической вольтамперометрии наибольшее применение нашли различного вида графитовые электроды. Это обусловлено широким диапазоном анодных потенциалов, низким электрическим сопротивлением и легкостью обновления поверхности электрода. В анодной области интервал поляризации графитовых электродов ограничен потенциалом выделения кислорода (+1,5В).
Последнее изменение этой страницы: 2016-07-23
lectmania.ru. Все права принадлежат авторам данных материалов. В случае нарушения авторского права напишите нам сюда...