
Категории:
ДомЗдоровьеЗоологияИнформатикаИскусствоИскусствоКомпьютерыКулинарияМаркетингМатематикаМедицинаМенеджментОбразованиеПедагогикаПитомцыПрограммированиеПроизводствоПромышленностьПсихологияРазноеРелигияСоциологияСпортСтатистикаТранспортФизикаФилософияФинансыХимияХоббиЭкологияЭкономикаЭлектроника
Основные классы неорганических соединений.
Тема №1.
Основные классы неорганических соединений.
Основные понятия и определения.
| Сильные кислоты | HClO4, H2SO4, HClO3, НBr, НCl, HI, НNО3, H2Cr2O7, H2CrO4, H2SеO4, HMnO4 | |
| Сильные основания (щелочи) элементов 1а,2а гр. ПС, кроме Ве. Мg | LiOH, NaOH, KOH, RbOH, CsOH, FrOH, Ba(OH)2, Ra(OH)2, Sr(OH)2, Ca(OH)2 | |
| Амфотерные Оксиды и гидроксиды | MnO2, Fe2O3, BeO, Al2O3, Cr2O3, ZnO, SnO2, PbO2, Be(OH)2, Al(OH)3, Cr(OH)3, Zn(OH)2 Sn(OH)4 Pb(OH)4 MnO(OH)2, Fe(OH)3 и др. | |
| Простые вещества | Простые вещества состоят из атомов одного химического элемента. Например, кислород, водород, фтор, медь, сера, алмаз, графит и др. | |
| Сложные вещества | Сложные вещества, или химические соединения, состоят из атомов различных химических элементов, связанных друг с другом химической связью. Например, оксид кальция, хлорид натрия, гидроксид натрия, серная кислота. | |
| Металлы | Металлы – это твердые при комнатной температуре вещества (за исключением ртути), с металлическим блеском, высокой тепло- и электропроводностью. Например, железо, цинк, хром, марганец, кальций, натрий и др. Металлы – простые вещества, в которых атомы связаны между собой металлической связью. | |
| Неметаллы | Неметаллы – полная противоположность металлам, вещества, состоящие из молекул: газы, жидкости, летучие твердые вещества, не обладают металлическим блеском, имеют низкую тепло- и электропроводность. Например, кислород, азот, бром, фосфор, сера и др. Неметаллы – простые вещества, в которых атомы связаны между собой ковалентными (или межмолекулярными) связями. | |
| Металлоиды | Металлоиды – это сложные вещества, обладающие промежуточными свойствами. Например, мышьяк, сурьма, висмут, селен и др. | |
| Оксиды | Оксидами (в русской химической традиции окислы) называются сложные соединения элемента с кислородом, в которых кислород имеет степень окисления -2. | |
| Основания | Основаниями, или гидроксидами (старые русские названия гидроокиси, гидраты окислов), называются сложные вещества, содержащие атом металла и одну или несколько гидроксильных групп –ОН. Основания – сложные вещества, образующие при диссоциации в качестве анионов только гидроксид- ионы. | |
| Кислоты | Кислотами называются сложные вещества, состоящие из атомов водорода, способных замещаться на металл, и кислотного остатка. Кислоты – сложные вещества, образующие при диссоциации в качестве катионов только ионы водорода. | |
| Соли | Солями называются сложные вещества, представляющие собой продукты полного или частичного замещения водорода в кислоте на металл или гидроксильной группы в основании на кислотный остаток. | |
| Амфотерные металлы. | это металлы, способные реагировать как с кислотами, так и со щелочами (как амфотерные оксиды или гидроксиды) | |
| Амфотерные оксиды | – оксиды, способные реагировать и с кислотами, и со щелочами. | |
| Амфотерные гидроксиды | - гидроксиды, способные реагировать и с кислотами, и со щелочами. | |
| Основные оксиды | – оксиды, способные реагировать с кислотами и не способные реагировать со щелочами. | |
| Кислотные оксиды | – оксиды, способные реагировать со щелочами и не способные реагировать с кислотами. | |
| Благородные металлы Au, Ru, Rh, Pd, Os, Ir, Pt. (Ag) | К ним из – за химической инертности относят золото, рутений, родий, палладий, осмий, иридий, платину. По традиции к благородным металлам относят и несколько более реакционно-способное серебро, но не относят такие инертные металлы, как тантал, ниобий и некоторые другие. | |
| Кислородсодержащие кислоты | (оксокислоты) – кислоты, в состав которых входят атомы кислорода. | |
| Бескислородные кислоты | – кислоты, молекулы которых не содержат кислорода. | |
| Безразличные оксиды | CO SiO NO N2O и др. (не солеобразующие) | |
Тема 2
Равновесие в растворах электролитов.
Реакции в растворах электролитов протекают при взаимодействии между ионами растворенных веществ. Реакции между ионами называются ионными реакциями, а уравнения таких реакций – ионными уравнениями. Реакции с участием электролитов записываются в виде двух уравнений (молекулярного и ионно-молекулярного) по следующему правилу:
формулы сильных электролитов пишут в виде ионов. К сильным электролитам принадлежат почти все растворы солей (кроме CdCl2, HgCl2, Fe(CNS)3, Pb(CH3COO)2), а также растворы следующих наиболее часто встречающихся кислот и оснований: НС1, HBr, HI, H2SO4, HNO3, НС1O4, НМnО4, LiOH, NaOH, КОН, RbОН, CsOH, Сa(ОH)2, Ва(ОН)2, Sr(OH)2;
Формулы слабых электролитов, газов и малодиссоциирующих веществ. следует писать в виде молекул.
Знак ↓, стоящий при формуле вещества, обозначает, что это вещество уходит из сферы реакции в виде осадка, знак ↑ обозначает, что вещество удаляется в виде газа. Обменные реакции протекают практически до конца, если продуктами реакции являются газы, осадки или слабые электролиты (Н2О).
Пример 1. Реакции с образованием газообразных веществ и слабых электролитов:
К2СО3 + H2SO4 = К2SO4 + Н2О + СО2;
2К+ + СО32- + 2H+ + SO42- = 2К+ + Н2О + СО2 + SO42- ;
СО32- + 2H+ = Н2О + СО2.
Одному ионно-молекулярному уравнению может соответствовать несколько молекулярных уравнений.
Соли.
Все типы солей образующиеся в зависимости от избытка или недостатка одного из исходных веществ: Al(OH)3 : H3PO4
| ИОНЫ | H2PO4 -1 | HPO4 -2 | PO4 -3 |
| Al(OH)2 +1 | H2O | H2O | (Al(OH)2)3PO4 дигидроксоортофосфат алюминия |
| AlOH +2 | H2O | H2O | (AlOH)3(PO4)2 гидроксоортофосфат алюминия |
| Al +3 | Al(H2PO4)3 дигидрофосфат алюминия | Al2(HPO4)3 Гидрофосфат алюминия | AlPO4 ортофосфат алюминия |
Соотношение атомов в формуле соли Al : P
1 Al(OH)3 + 3H3PO4 = 1 Al(H2PO4)3 1: 3
1 Al(OH)3 + 1,5 H3PO4 = 0,5 Al2(HPO4)3 2: 3
1 Al(OH)3 + 1 H3PO4 =1 AlPO4 1:1
1,5 Al(OH)3 + 1 H3PO4 = 0,5 (AlOH)3(PO4)2 3: 2
3 Al(OH)3 + 1 H3PO4 = 1 (Al(OH)2)3PO4 3: 1
Пример 1. Как зависят кислотно-основные свойства оксидов и гидроксидов от степени окисления атомов элементов, их образующих? Какие гидроксиды называются амфотерными?
Решение. Если данный элемент проявляет переменную степень окисления и образует несколько оксидов и гидроксидов, то с увеличением степени окисления свойства последних меняются от основных к амфотерным и кислотным.
(Например: Мn(ОН)2 ® Мn(ОН)4 ® Н2MnO4 ® НМnO4).
Это объясняется характером электролитической диссоциации (ионизации) гидроксидов ЭОН, которая в зависимости от сравнительной прочности и полярности связей Э-ОН и О-Н может протекать по двум типам:
Э-О-Н
ЭОН→ Э+ + OH- (I)
ЭОН→ЭО- + Н+ (II)
Полярность связей, в свою очередь, определяется разностью электроотрицательностей элементов, размерами и эффективными зарядами атомов. Диссоциация по кислотному типу (II) протекает, если ео-h << еэ-о (высокая степень окисления), а по основному типу – если еo-h >> еэ-о (низкая степень окисления). Если прочности связей О-Н и Э-О близки или равны, диссоциация гидроксида может одновременно протекать и по (I), и по (II) типам. В этом случае речь идет об амфотерных электролитах (амфолитах):
Эn+ + nОH- → Э(ОН)n НnЭОn → nH+ + Э 
как основание как кислота
Э – элемент, n – его положительная степень окисления. В кислой среде амфолит проявляет основной характер, а в щелочной среде – кислотный характер:
Ga(OH)3 + 3НС1 = GаС13 + 3Н2О
Ga(OH)3 + 3NaOH = Na3GaO3 + 3Н2О.
Пример 1. Составьте формулу нормальной (средней) соли кальция и ортофосфорной кислоты.
Решение. Формула ортофосфорной кислоты Н3РО4. Катион кальция - Са2+.
Нормальная средняя соль образована катионом металла и анионом кислотного остатка. Молекула соли, образованная ионами РО43- и катионом кальция - Са2+, должна быть электронейтральна. Наименьшее общее кратное чисел 2 и 3 (заряды ионов) равно 6. Поэтому молекула соли должна содержать 6 : 2 = 3 иона кальция и 6 : 3 = 2 кислотных остатка РО43-. Формула соли Са3(РО4)2.
Пример 2. Составьте формулу основной соли железа (III) и соляной кислоты.
Решение.Формула основной соли должна содержать кислотные остатки иона Сl1-, катиона Fe3+ и ОН1- группы. Так как в молекуле гидроксида железа (III) всего 3 ОН1- группы, а остатка с ОН1- - группами возможно 2 (Fe(OH)2+1 и Fe(OH)+2), то и основных солей Fe(III) может быть две: Fe(OH)2Cl и Fе(ОН)С12.
Пример 3. Составьте уравнения реакций между соответствующими кислотами и основаниями, приводящими к образованию солей: нитрата никеля, гидрокарбоната натрия, сульфата железа.
Решение. Соль Ni(NO3)2 можно получить при взаимодействии основания Ni(OH)2 и азотной кислоты HNO3:
Ni(OH)2 + 2HNO3 = Ni(NO3)2 + 2H2O.
Кислую соль – гидрокарбонат натрия получают при взаимодействии основания NaOH и слабой неустойчивой кислоты Н2СО3, вместо нее следует в раствор NaOH пропускать СО2 - углекислый газ:
NaOH + CO2 = NaHCO3.
Сульфат железа получают взаимодействием Fe(OH)3 и серной кислоты:
2Fe(OH)3 + 3H2SO4 = Fe2(SO4)3 + 6Н2О.
Тема № 3.
Закон эквивалентов.
Закон эквивалентов относится к Важнейшим законам, образующим основу химии как фундаментальной науки. Без его усвоения невозможны количественные химические расчеты.
Основные понятия и определения.
| Эквивалент элемента ( вещества) | - количества элемента (вещества), присоединяющее или замещающее в химических реакциях один моль атомов водорода [моль]. |
| Эквивалентная масса | - масса одного эквивалента [г/моль]. |
| Эквивалентный объем | - одного эквивалента [л/моль]. |
| Закон эквивалентов | - массы реагирующих веществ относятся между собой как молярные массы их эквивалентов  
|
Пример 1. Определите эквивалент и эквивалентные массы элементов в соединениях НВr, Н2О и NН3.
Решение. В указанных соединениях с 1 молем атомов водорода соединяется 1 моль атомов брома, 1/2 моля атомов кислорода и 1/3 моля атомов азота. Следовательно, согласно определению, эквиваленты брома, кислорода и азота равны соответственно 1 молю, 1/2 и 1/3 моля. Исходя из мольных масс атомов этих элементов, находим, что эквивалентная масса брома равна
79,9 г/моль, кислорода – 16 х 1/2 = 8 г/моль, азота – 14 x 1/3 =
= 4,67 г/моль.
Для определения эквивалента (эквивалентной массы) элемента необязательно исходить из его соединения с водородом. Эквивалент (эквивалентную массу) можно вычислить по составу соединения данного элемента с любым другим, эквивалент которого известен.
Пример 2. При соединении 5,6 г железа с серой образовалось 8,8 г сульфида железа. Найдите эквивалентную массу железа ЭFе и его эквивалент, если известно, что эквивалентная масса серы равна 16 г/моль.
Решение. Из условия задачи следует, что в сульфиде железа на 5,6 г железа приходится:
8,8 - 5,6 = 3,2 г серы.
Согласно закону эквивалентов, массы взаимодействующих веществ пропорциональны их эквивалентным массам. Следовательно:
5,6 г железа эквивалентны 3,2 г серы
ЭFе г/моль железа эквивалентны 16 г/моль серы.
Откуда ЭFе = 5,6 x 16/3,2 = 28 г/моль.
Мольная масса атомов железа, численно совпадающая с его относительной молекулярной массой, равна 56 г/моль. Поскольку эквивалентная масса железа (28 г/моль) в два раза меньше мольной массы его атомов, то в 1 моле железа содержится 2 эквивалента. Следовательно, эквивалент железа равен 1/2моля.
На основе закона эквивалентов можно вывести следующие формулы для вычисления эквивалентных масс сложных веществ:
Эоксида = Моксида/Число атомов элемента х валентность элемента
Экислоты= Мкислоты/Основность кислоты
Эоснования=Моснования/Кислотность основания
Эсоли=Мсоли/Число атомов металла х валентность металла,
здесь М – мольная масса соединений.
Пример 3. Определите массу гидросульфата натрия, образующегося при нейтрализации серной кислотой раствора, содержащего 8 г NaOH.
Решение. Находим эквивалентную массу гидроксида натрия:
Э(NaOH) = M(NaOH)/1 = 40 г/моль. Следовательно, 8 г NaOH составляют 8/40 = 0,2 эквивалентной массы NaOH. Согласно закону эквивалентов, масса образовавшейся соли также составляет 0,2 ее эквивалентной массы.
Находим эквивалентную массу соли: NaHSО4 = M(NaHSO4)/I =
= 120 г/моль. Масса образовавшегося гидросульфата натрия равна 120 х 0,2 = 24 г.
При решении некоторых задач, содержащих сведения об объемах газообразных участников реакции, целесообразно пользоваться значением эквивалентного объема.
Эквивалентным объемом называется объем, занимаемый при данных условиях 1 эквивалентом вещества. Значение эквивалентного объема вещества, находящегося в газообразном состоянии, можно найти, зная, что в мольном объеме любого газа, состоящего из одноатомных молекул, содержится 1 моль атомов, состоящего из двухатомных молекул – 2 моля атомов и т. д. Так, в 22,4 л Н2 содержатся при нормальных условиях 2 моля атомов водорода. Поскольку эквивалент водорода равен 1 моль, то в
22,4 л Н2 содержатся 2 эквивалента водорода; значит, эквивалентный объем водорода равен 22,4/2= 11,2 л/моль.
Пример 4. Некоторое количество металла, эквивалентная масса которого равна 28 г/моль, вытесняет из кислоты 0,7 л водорода, измеренного при нормальных условиях. Определите массу металла.
Решение. Зная, что эквивалентный объем водорода равен 11,2 л/моль, составляем пропорцию:
28 г металла эквивалентны 11,2 л водорода
хгметалла эквивалентны 0,7 л водорода
х = 0,7 x 28 / 11,2 = 1,75 г.
Контрольные задания:
1. Рассчитайте эквивалентную массу соли Мора в реакции:
(NH4 )2Fe(SO4)2 + 2NH4ОН = 2(NH4 )2SO4 + Fe(ОН)2
2. Рассчитайте эквивалентную массу железоаммонийных квасцов реакции:NH4 Fe(SO4)2 + 3 NH4ОН = 2(NH4 )2SO4 + Fe(ОН)3
3. Рассчитайте эквивалентную массу гидроксида алюминия в реакции: Al(ОН)3 + H2SO4 = AlОНSO4 + 2H2O
4. Рассчитайте эквивалентную массу гидросульфата натрия в реакции:NaHSO4 + ВаCl2 = NaCl + HCl + ВаSO4
5. Рассчитайте эквивалентную массу фосфата кальция в реакции:Ca3(РО4)2 + 2H2SO4 = Ca(H2РO4)2 + CaSO4
6. Рассчитайте эквивалентную массу восстановителя в реакции: MnO2 + NaNO3 + 2 NaOH = Na2MnO4 + NaNO2 + 2H2O
7. Рассчитайте эквивалентную массу восстановителя и окислителя в реакции: 3Cu + 2HNO3(окислитель) + 6HNO3(среда) = 3Cu(NO3)2 + 2NO + 4H2O
8. Рассчитайте эквивалентную массу восстановителя в реакции: 3SO2 + K2Cr2O7 + H2SO4 (разб) = Cr2(SO4)3 + K2SO4 + H2O.
9. Рассчитайте эквивалентную массу восстановителя в реакции:14HCl + K2Cr2O7 = 2CrCl3 + 3Cl2 +2 KCl + 7H2O
10. Рассчитайте эквивалентную массу восстановителя в реакции:5NaClO2 + 2KMnO4 + 3H2SO4 (разб ) = 5NaClO3 + 2MnSO4 + 3H2O + K2SO4
11. Рассчитайте эквивалентную массу металла, 0,46 г которого вытеснили из кислоты 62,35 мл водорода, собранного над водой при температуре 17 0 С и давлении 1,017·105 Па.
12. При окислении 2,28 г металла образуется 3,78 г его оксида. Рассчитайте эквивалентную и молярную массу металла, валентность которого равна 2.
13. При восстановлении 1,17 г оксида олова водородом образовалось 0,16 г воды. Рассчитайте эквивалентную массу олова.
14. Рассчитайте эквивалентную массу металла, если известно, что 0,05 г его вытесняют из кислоты 28 мл водорода (н.у).
15. Рассчитайте эквивалентную массу и укажите двухвалентный металл, 6,5 г которого вытесняют из кислоты 2,24 л водорода (н.у).
16. При термическом разложении оксида серебра(I) образовалось 2,158 г серебра и 0,16 г кислорода. Рассчитайте эквивалентную и молярную массу металла.
17. Рассчитайте эквивалентную массу металла, если 3,4 г иодида этого метала содержит 1,9 г йода, эквивалентная масса которого равна 126,9 г/моль.
18. Металл образует два хлорида, содержащих 37,45% и 54,51% хлора. Рассчитайте эквивалентную массу металла в каждом хлориде, если эквивалентная масса хлора равна 35,5 г/моль.
19. Рассчитайте эквивалентную массу металла, 0,5 г которого вытесняют 190 мл водорода, измеренного при температуре 210С и давлении 101,325 кП.
20. При сгорании 5,00 г металла образуется 9,44 г оксида металла. Определить эквивалентную массу металла.
21. Вычислить атомную массу двухвалентного металла и определить, какой это металл, если 8,34 г металла окисляются 0,680 л кислорода (условия нормальные).
22. Чему равны молярные массы эквивалента фосфора в оксидах, содержащих: а) 43,81 мас.%, б) 56,51 мас.% Р?
23. Определите молярную массу эквивалента металла, если 0,327 г его вытесняют из раствора соляной кислоты 112 мл водорода при н.у.
24. При взаимодействии 22,48 г металла с разбавленной серной кислотой израсходовано 19,6 г H2SO4. Вычислите молярную массу эквивалента металла.
25. На восстановление 11,925 г оксида металла израсходовано 3,336 л водорода при н.у. Вычислите молярную массу эквивалента металла.
26. Массовая доля металла в хлориде составляет 73,8%. Определите молярную массу эквивалента металла.
27. Используя закон эквивалентов, определите массу оксида железа (III), образовавшуюся в результате окисления 3,72 г железа кислородом.
28. На реакцию с 8,2 г Н3РО3 израсходовано 5,6 г КОН. Вычислите молярную массу эквивалента Н3РО3 в реакции. Запишите уравнение реакции.
29. Вычислите молярные массы эквивалентов гидроксида железа (III) в реакциях его взаимодействия с соляной кислотой при условии, что количество взятой для реакции кислоты меняется от одного до трех моль.
30. При взаимодействии 3,24 г трехвалентного металла с кислотой выделяется 4,03 л водорода, измеренного при н.у. Вычислите молярную массу эквивалента металла и его атомную массу.
31. Массовая доля хрома в оксидах хрома составляет соответственно 52,10%; 68,51%; 76,54%. Вычислите молярные массы эквивалентов каждого из оксидов и составьте их формулы.
32. Вычислите эквивалент и эквивалентную массу фосфорной кислоты Н3РO4 в реакциях образования: а) гидрофосфата, б) дигидрофосфата, в) фосфата.
33. Чему равен при нормальных условиях эквивалентный объем кислорода? Подсчитайте. На сжигание 3 г двухвалентного металла требуется 1,38 л кислорода (н.у.). Вычислите эквивалентную массу и мольную массу этого металла.
34. При сгорании 10,00 г металла образуется 18,88 г оксида металла. Определите эквивалентную массу металла.
35. Масса 1 л кислорода равна 1,4 г. Сколько литров кислорода расходуется при сгорании 21 г магния, эквивалент которого равен 1/2 моля?
36. В каком количестве Сr(ОН)3 содержится столько же эквивалентов, сколько в 174,96 г Mg(OH)2?
37. Одинаков ли эквивалент хрома в соединениях СrCl3 и Cr2(SO4)3 и эквивалентная масса железа в соединениях FeCl2 и FеCl3? Дайте мотивированный ответ.
38. Определите эквивалентные массы металла и серы, если 3,24 г металла образуют 3,48 г оксида и 3,72 г сульфида.
39. Из 6,62 г нитрата металла получается 5,56 г его хлорида. Вычислите эквивалентную массу этого металла.
40. При взаимодействии 6,48 г трехвалентного металла с кислотой выделяется 8,06 л водорода (н.у.). Вычислите эквивалентную и мольную массу металла.
41. На восстановление 1,8 г оксида металла пошло 833 мл водорода при н.у. Вычислите эквивалентные массы оксида и металла.
42. Вычислить молярные массы эквивалентов Al(OH)3 в реакциях взаимодействия с соляной кислотой при получении: а) Al(OH)2Cl; б) Al(OH)Cl2; в) AlCl3.
43. При взаимодействии 2,5г карбоната металла с азотной кислотой образовалось 4,1г нитрата этого же металла. Вычислите молярную массу эквивалента металла.
Тема № 4.
Основные законы химии.
Основные понятия и определения.
| Закон Авогадро | Одинаковые объемы различных газов при одинаковых условиях (температуре и давлении) содержат одинаковое число молекул. |
| Vm – молярный объем газа (дм³/моль = л/моль);V – объем вещества, n – количество вещества системы. Точное значение молярного объема газа 22.4135±0.0006 | При нормальных условиях 1 моль любого газа занимает объем, равный 22.4л. Этот объем называется молярным объемом газа. при нормальных условиях (при температуре 273ºК (0ºС) и давлении 1 атм.)


 = 6,02* 10 23частиц = 6,02* 10 23частиц
|
| D-относительная плотность газа. | Отношение массы определенного объема одного газа к массе такого же другого газа, взятого при тех же условиях (объем, температура, давление), называется плотностью первого газа по второму. |
| Закон Бойля - Мариота | При постоянной температуре объем данного количества газа обратно пропорционально давлению, под которым он находится. 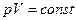 , где
p-давление; V-объем газа
Закон Бойля-Мариотта выполняется при очень малых давлениях , где
p-давление; V-объем газа
Закон Бойля-Мариотта выполняется при очень малых давлениях
|
| Закон Гей-Люссака | При постоянном давлении изменение объема газа прямо пропорционально температуре.  , где
T – абсолютная температура (К) , где
T – абсолютная температура (К)
|
| Закон объемных отношений | При одинаковых условиях (при неизменной температуре и давлении) объемы газов, вступающих, в реакцию, относятся друг к другу, а так же к объемам газообразных продуктов, как небольшие целые числа. |
| Закон действующих масс | Скорость химической реакции пропорциональна концентрации регулирующих веществ. |
| Закон постоянства состава вещества | Всякое чистое вещество независимо от способа его получения имеет постоянный качественный и количественный состав. Состав молекулярной структуры, т. е. состоящих из молекул является постоянным независимо от способа получения. Состав соединений с молекулярной структурой (с атомной, ионной и металлической решеткой) не является постоянным и зависит от условий получения. |
| Закон сохранения массы вещества | Масса веществ, вступивших в химическую реакцию, равна массе веществ, образующихся в результате реакции. |
| Моль | – количество вещества, содержащее столько молекул, атомов, ионов, электронов или других структурных единиц, сколько содержится атомов в 12 г изотопа углерода-12. |
| Закон эквивалентов | - массы реагирующих веществ относятся между собой как их эквивалентные массы 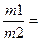 
|
Пример 1. Выразите в граммах массу одной молекулы СО2.
Решение. Относительная молекулярная масса СО2 равна 44,0. Следовательно, мольная масса СО2 равна 44,0 г/моль. В
1 моле СО2 содержится 6,02×1023 молекул. Отсюда находим массу одной молекулы: М молекулы = 44,0 : (6,02 × 1023) = 7,31×10-23 г.
Согласно закону Авогадро, в равных объемах любых газов, взятых при одной и той же температуре и одинаковом давлении, содержится одинаковое число молекул.
Иными словами, одно и то же число молекул любого газа занимает при одинаковых условиях один и тот же объем. Вместе с тем 1 моль любого газа содержит одинаковое число молекул. Следовательно, при одинаковых условиях 1 моль любого газа занимает один и тот же объем. Этот объем называется мольным объемом газа и при нормальных условиях (0 °С, давление 101,325 кПа) равен 22,4 л.
Объемным содержанием газа в газовой смеси называется часть объема газовой смеси, которую занимало бы содержащееся в ней количество данного газа при той же температуре и парциальном давлении, равном общему давлению газовой смеси. Эта величина может быть выражена в долях общего объема (объемная доля) или в процентах от общего объема (% по объему).
Например, утверждение «содержание диоксида углерода в воздухе составляет 0,03% (об.)» означает, что при парциальном давлении СО2, равном общему давлению воздуха, и при той же температуре диоксид углерода, содержащийся в воздухе, займет 0,03 % общего объема, занимаемого воздухом.
Пример 2. Сколько молей кислорода находится в 1 л воздуха, если объемное содержание его составляет 21 % (н.у.)?
Решение. При нормальных условиях кислород, содержащийся в 1 л воздуха, займет объем 0,21 л. Зная мольный объем кислорода, находим число его молей в 0,21 л О2:
1 моль занимает объем 22,4 л
х молей занимает объем 0,21 л
х = 0,21/22,4 = 0,093 моля O2.
Пример 3. Определите объем, занимаемый 5,25 г азота при 26 °С и давлении 98,9 кПа (742 мм рт. ст.).
Решение. Зная мольный объем и мольную массу
(28,0 г/моль) азота, находим объем, который будут занимать 5,25 г азота при нормальных условиях
28,0 г азота занимают объем 22,4 л
5,25 г азота занимают объем Vo
откуда Vo = 5,25 х 22,4/28,0 = 4,2 л.
Затем приводим полученный объем к указанным в задаче условиям:
V = PoVoTo / (РТо) = 101,3 х 4,2 x 299 / (98,9 x 273) = 4,71 л.
Тема № 5.
Строение атома.
Представления о строение атома необходимо при изучении периодического закона Д.И.Менделеева, химической связи и свойств соединений. Без знания строения атома невозможно материалистическое понимание химических и биологических наук.
Основные понятия и определения.
| Атом | - электронейтральная микросистема, состоящая из положительно заряженного ядра и отрицательно заряженных электронов. |
| Атомное ядро | - частица, расположенная в центре атома, состоит из протонов, имеет положительный заряд, равный числу протонов. |
| Массовое число | -сумма протонов (Z) и нейтронов (N), входящих в состав ядра: А = Z+ N. |
| Элемент | -совокупность атомовс одинаковым зарядом ядра. |
| Изотопы | -разновидности одного и того же химического элемента,отличающиеся массой атома. |
| Атомная орбиталь (АО) | -область околоядерного пространства, в котором наиболее вероятно нахождения электрона. |
| Квантовые числа | - характеристики состояния электрона в атома. |
| Энергетический уровень | -состояние электрона в атоме, характеризующеесяопределенным значением главного квантового числа n |
| Энергетический подуровень | -состояние электрона в атоме, характеризующееся определенными значениями квантовых чисел n и l |
| Основное состояние атома | - состояние атома с наименьшей энергией; электрон в основном состоянии связан с ядром наиболее прочно |
| Возбужденное состояние атома | - состояние с высоким уровнем энергии; при возбуждении атома связь электрона с ядром ослабевает |
| Валентные электроны | -электроны, принимающие участие в образовании химических связей |
Характеристика квантовых чисел:
| Квантовые числа | Возможные значения | Число значений | Определяют |
| Главное n | 1,2,3… 
| 
| основной запас энергии электрона, размеры электронного облака, энергетический уровень |
| Орбитальное l | 0,1,2,3… (n-1) | n | форму электронного облака, энергетический подуровень |
| Магнитное m | -1,…,0,…,+1 | 2l+1 | Пространственную ориентацию электронного облака |
| Спиновое s | ±1/2 | Собственный момент количества движения электрона |
Последовательность заполнения электронами АО в соответствии с правилами Клечковского:
| Тип орбитали | Главное квантовое число n | Орбитальное квантовое число l | n + l | Тип орбитали | Главное квантовое число n | Орбитальное квантовое число l | n + l | |
| 1s | 5p | |||||||
| 2s | 6s | |||||||
| 2p | 4f | |||||||
| 3s | 5d | |||||||
| 3p | 6p | |||||||
| 4s | 7s | |||||||
| 3d | 5f | |||||||
| 4p | 6d | |||||||
| 5s | 7p | |||||||
| 4d |
Пример 1. Составьте электронную формулу атома элемента с порядковым номером 16. Покажите расположение электронов этого атома по энергетическим ячейкам.
Решение. Электронные формулы отображают распределение электронов в атоме по энергетическим уровням, подуровням (атомным орбиталям). Электронные конфигурации обозначаются группами символов n  х, где n – главное квантовое число,
х, где n – главное квантовое число,  –орбитальное квантовое число (вместо него указывают соответствующее буквенное обозначение s, p, d, f), х – число электронов в данном подуровне (орбитали). При этом следует учитывать, что электрон занимает тот энергетический подуровень, на котором обладает наименьшей энергией – меньшей суммой n+
–орбитальное квантовое число (вместо него указывают соответствующее буквенное обозначение s, p, d, f), х – число электронов в данном подуровне (орбитали). При этом следует учитывать, что электрон занимает тот энергетический подуровень, на котором обладает наименьшей энергией – меньшей суммой n+  (правило Клечковского). Последовательность заполнения энергетических уровней и подуровней следующая:
(правило Клечковского). Последовательность заполнения энергетических уровней и подуровней следующая:
1s→2s→2p→3s→3p→4s→3d→4p→5s→4d→5p→6s→5d1→
→4f→5d→6p→7s→6d1-2→5f→6d→7p.
Так как число электронов в атоме того или иного элемента равно его порядковому номеру в таблице Менделеева, то для элемента № 16 (сера) электронная формула будет иметь вид: 1s22s22p63s23p4.
Электронная структура атомов может быть изображена также в виде схемы размещения электронов в квантовых (энергетических) ячейках, которые являются схематическими изображениями атомных орбиталей (АО), квантовую ячейку изображают в виде прямоугольника или линейки, а электроны в этих ячейках обозначают стрелками. В каждой квантовой ячейке может быть не более двух электронов с противоположными спинами ↑↓ (принцип Паули).
Орбитали данного подуровня заполняются сначала по одному электрону с одинаковыми спинами, а затем по второму электрону с противоположными спинами (правило Хунда).
Контрольные задания:
1.Напишите электронные формулы атомов фосфора и меди. Укажите, к какому электронному семейству относится каждый из элементов, и определите число протонов и нейтронов в ядре их атомов.
2.Укажите последовательность заполнения электронами атомных орбиталей 4d, 5s, 6s, 5р и сформулируйте правило, определяющее эту последовательность.
3.Напишите электронно- графические формулы атомов элементов с порядковыми номерами 15 и 27. определите число нейтронов и электронов в их атомов.
4.В соответствии с принципом Паули укажите максимальное число электронов на s-, р-, d-, f- подуровнях данного энергетического уровня.
5.Дайте определение понятия изотоп. Объясните причину нецелочисленных значений атомных масс большинства химических элементов. Вычислите атомную массу серебра, если известно, что массовые доли изотопов в природном серебре составляют соответственно 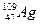 - 40% и
- 40% и 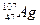 - 60%.
- 60%.
6.Дайте определения понятия s-, р-, d-, f- элемент. Приведите примеры.
7.Энергетическое состояние электрона в атоме описывается четырьмя квантовыми числами n, l, m, s.укажите, какие значения может принимать каждое из них. Определите набор квантовых чисел для внешнего электрона атома натрия.
8.Составьте электронные формулы атомов элементов с порядковыми номерами 17 и 25. Укажите, к какому электронному семейству относится каждый из них. Приведите электронные и электронно - графические формулы атомов элементов II периода, которые могут иметь на р – подуровне один электрон, учитывая как основное, так и возбужденное состояние атома.
9.Укажите число квантовых d – орбиталей в основном состоянии у атомов элементов с порядковыми номерами 23, 42, 47, 49.
10.Составьте электронные формулы атомов элементов с порядковыми номерами 14, 25 и укажите, к какому электронному семейству они относятся.
11.Объясните физический смысл главного и орбитального квантовых чисел и укажите, какие значения они принимают.
12.Объясните физический смысл магнитного квантового числа и укажите, какие значения оно может принимать при данном числовом и буквенном значении орбитального квантового числа. Заполните таблицу:

| m | |
| Числовое значение | Буквенное значение | |
| s | ||
13.Напишите электронную формулу элемента, в атоме которого содержится один электрон на 3d – орбитали. Укажите период, группу и символ этого электрона.
14.Приведите формулы, позволяющие рассчитать электронную емкость энергетического уровня и подуровня, а также число орбиталей на данном уровне и подуровне.
15.Сформулируйте правило Клечковского. Определите порядок заполнения электронами орбиталей 3d, 4s, 4р, 5s, 5р.
16.Укажите период, группу и символ химического элемента, атому которого соответствует электронная формула: [Ne ] 3s2 3р6 3d5 4s2. К какому электронному семейству он относится?
17.Укажите возможные значения квантовых чисел для электронов второго и третьего энергетических уровней. Заполните таблицу:
| n | 
| m | s |
18.Укажите число протонов и нейтр
Последнее изменение этой страницы: 2016-07-23
lectmania.ru. Все права принадлежат авторам данных материалов. В случае нарушения авторского права напишите нам сюда...