
Категории:
ДомЗдоровьеЗоологияИнформатикаИскусствоИскусствоКомпьютерыКулинарияМаркетингМатематикаМедицинаМенеджментОбразованиеПедагогикаПитомцыПрограммированиеПроизводствоПромышленностьПсихологияРазноеРелигияСоциологияСпортСтатистикаТранспортФизикаФилософияФинансыХимияХоббиЭкологияЭкономикаЭлектроника
Энергетика химических процессов. Термохимия. Определение тепловых эффектов.
Раздел химии, изучающий энергетические эффекты, сопровождающие химические процессы, направления и пределы их самопроизвольного протекания, называются химической термодинамикой.
Энергетика химических реакций позволит предсказать возможность химических и физико-химических процессов, рассчитывать энергетические эффекты и энергозатраты, предупреждать нежелательные реакции в тех или иных устройствах и установках.
Основные понятия и определения:
| Система | - совокупность находящихся во взаимодействии веществ или частиц, мысленно или фактически обособленная от окружающей среды |
| Термодинамические параметры | - величины, характеризующие энергетическое состояние системы ( P,T,C,V) |
Процессы:
| Процессы перехода системы из одного состояния в другое при: P =const V =const T= const; P =const T= const; |
| Характеристические функции: - внутренняя энергия (U) - энтальпия (H) - энтропия (S) - энергия Гиббса / изобарно-изотермический потенциал/ ( G) | - функции, характеризующие термодинамические свойства системы: - сумма всех видов энергии системы ( энергия движения и взаимодействия молекул, атомов, ядер и других частиц, внутриядерная и другие виды энергии) - энергосодержащие системы, включающее внутреннюю энергию и работу H= U+PV - мера неупорядоченности системы - свободная энергия системы при P, T= const, критерий самопроизвольного протекания химических реакций |
| Термохимия | - раздел химии, изучающий тепловые эффекты химических реакций и фазовых превращений |
| Термохимические уравнения | - уравнения процессов, в которых указаны тепловые эффекты |
Тепловой эффект химической реакции
( энтальпия  H) H)
| - изменение энергии системы при протекании в ней химической реакции при условии, что система не совершает никакой другой работы, кроме работы расширения; в изобарических условиях тепловой эффект реакции равен изменению энтальпии системы |
Стандартная энтальпия реакции  H0 H0
| - тепловой эффект реакции при условии, что исходные вещества и продукты находятся в стандартном состоянии ( P = 101,3 кПа, С = 1 моль/л ) |
| Экзотермическая реакция | - реакция, протекающая с выделением теплоты (  H < 0, Q > 0 ); экзотермическими являются процессы кристаллизации, конденсации, перехода в аморфное состояние из кристаллического H < 0, Q > 0 ); экзотермическими являются процессы кристаллизации, конденсации, перехода в аморфное состояние из кристаллического
|
| Эндотермическая реакция | - реакция, протекающая с поглощением теплоты (  H> 0, Q < 0); эндотермическими являются процессы плавления, сублимации ( переход твердого в газ), парообразования H> 0, Q < 0); эндотермическими являются процессы плавления, сублимации ( переход твердого в газ), парообразования
|
Энтальпия (теплоты) образования (  Hобр.) Hобр.)
| - тепловой эффект образования 1 моль вещества из простых веществ, устойчивых при Т = 298К, Р = 101,3 КПа |
| Закон Гесса | - тепловой эффект реакции зависит от природы и состояния исходных веществ и конечных продуктов, но не зависит от пути реакции, то есть от числа и характера промежуточных стадий |
| Следствие из закона Гесса | - энтальпия химической реакции равна сумме энтальпий образования продуктов реакции за вычетом суммы энтальпий образования веществ с учетом стехиометрических коэффециетов, например, тепловой эффект реакции
СН4 + 2Н2О(г) = СО2 + 4 Н2
определяются по уравнению
 H=( H=(  Hобр СО2 + 4 Hобр СО2 + 4  Hобр Н2) – ( Hобр Н2) – (  H СН4 + 2 H СН4 + 2  Hобр Н2О(г)) Hобр Н2О(г))
|
| Калориметрия | - экспериментальное определение тепловых эффектов с помощью определенных приборов - калориметров |
Удельная теплоемкость ( 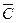 ) )
| - количество теплоты, необходимое для повышения температуры 1кг вещества на1 К |
| Самопроизвольные процессы | - процессы, протекающие без подвода энергии от внешнего источника |
| Термодинамическая вероятность системы(W) | - число микросостояний, посредством которых осуществляется данное макросостояние системы |
| Связь между G,H,S,T |  G= G=  H - T H - T  S, где S, где
 H – энтальпийный фактор
T H – энтальпийный фактор
T  S – энтропийный фактор S – энтропийный фактор
|
| Условия самопроизвольного протекания химической реакции |  G < 0 G < 0  S >0 S >0
|
Пример 1. Исходя из теплоты образования газообразного диоксида углерода (DН° = -393,5 кДж/моль) и термохимического уравнения
С (графит) + 2N2О (г.) = СО2 (г.) + 2N2 (г.);DН°= - 557,5 кДж, (1) вычислите теплоту образования N2O (г.).
Решение. Обозначив искомую величину через х, запишем термохимическое уравнение образования N2О из простых веществ:
N2 (г.) + 1/2О2 (г.) = N2O (г.); DН°= х кДж. (2)
Запишем также термохимическое уравнение реакции образования СО2(г). из простых веществ:
С (графит) + О2 (г.) = СО2 (г.); Н°2 = - 393,5 кДж. (3)
Из уравнений (2) и (3) можно получить уравнение (1). Для этого умножим уравнение (2) на два и вычтем найденное уравнение из (3). Имеем: С(графит) + 2N2O(г.) = СО2(г.) + 2N2(г.);
DН°1= (-393,5 - 2х) кДж. (4)
Сравнивая уравнения (1) и (4), находим: -393,5-2х = -557,5, откуда х = 82,0 кДж/моль.
Пример 2. Вычислите тепловой эффект образования аммиака из простых веществ при стандартном давлении и 298 К по тепловым эффектам реакций:
2Н2+О2 = 2Н2О(ж) + DН°1 (1)
4NH3 +3О2 = 6Н2O(ж) +2N2 + DH°2 (2)
DН°1, = -571,68 кДж, DН°2 = -1530,28 кДж.
Решение. Запишем уравнение реакции, тепловой эффект которой необходимо определить:
1/2 N2 + 3/2 H2 = NH3 +DН° (3)
Н2О (ж) и О2 не входят в уравнение (3), поэтому, чтобы исключить их из уравнений (1) и (2), умножим уравнение (1) на 3 и вычтем из него уравнение (2):
6Н2+ 3О2 -4NНз - 3О2=6Н2О(ж) +3DН°1 - 6Н2О(ж) - 2N2 - DН°2 .(4)
После преобразования уравнения (4) и деления его на 4 получим: 3/2Н2 + 1/2N2 = NH3 + (3DН°1 - DН2)/4 =
= [3 (-571,68) - (-1530,28)]/4 = -46,19 кДж/моль.
Следствие из закона Гесса:
Стандартное изменение энтальпии химической реакции равно сумме стандартных энтальпий образования продуктов реакции за вычетом суммы стандартных энтальпий образования исходных веществ.
При каждом суммировании следует учитывать, в соответствии с уравнением реакции, число молей участвующих в реакции веществ.
Пример 3. Определите стандартное изменение энтальпии ΔН° реакции горения метана
СН4 (г.) + 2О2 (г.) = СО2 (г.) + 2Н2О (г.)
зная, что энтальпии образования СО2(г.), Н2О(г.) и CH4(г.) равны соответственно -393,5, -241,8 и -74,9 кДж/моль.
Решение. Согласно следствию из закона Гесса и учитывая, что ΔН°(О2)=0:
ΔН° = ΔН°(СО2) + 2ΔН°(Н2О) - ΔН°(СН4).
Используя данные задачи, для искомой величины найдем
ΔН° = -393,5 - 241,8 • 2 + 74,9 = -802,2 кДж.
Направление, в котором самопроизвольно протекает химическая реакция, определяется совместным действием двух факторов:
· тенденцией к переходу системы в состояние с наименьшей внутренней энергией (в случае изобарных процессов – с наименьшей энтальпией);
· тенденцией к достижению наиболее вероятного состояния, т. е. состояния, которое может быть реализовано наибольшим числом равновероятных способов (микросостояний).
Мерой первой из этих тенденций для изобарных процессов служит изменение энтальпии химической реакции: отрицательный знак ΔНуказывает на уменьшение, а положительный – на возрастание энтальпии системы.
Мерой вероятности состояния системы в термодинамике принято считать энтропию S –величину, пропорциональную логарифму числа равновероятных микросостояний, которыми может быть реализовано данное макросостояние. Энтропия имеет размерность энергии, деленной на температуру. Обычно ее относят к 1 молю вещества (мольная энтропия) и выражают в Дж/(моль×К).
Энтропия возрастает при переходе вещества из кристаллического состояния в жидкое и из жидкого – в газообразное, при растворении кристаллов, при расширении газов, при химических взаимодействиях, приводящих к увеличению числа частиц, и прежде всего, частиц в газообразном состоянии. Напротив, все процессы, в результате которых упорядоченность системы возрастает (конденсация, полимеризация, сжатие, уменьшение числа частиц), сопровождаются уменьшением энтропии.
Пример 4. Не производя вычислений, определите знак изменения энтропии в следующих реакциях:
NН4NO3 (к) = N2О(г) + 2Н2О(г) (1)
2Н2(г) + О2(г) = 2Н2О(ж) (2)
2Н2(г) + О2(г) = 2Н2О(г) (3)
Решение. В реакции (1) 1 моль вещества в кристаллическом состоянии образует 3 моля вещества газов, следовательно, ΔS1 > 0. В реакциях (2) и (3) уменьшается как общее число молей, так и число молей газообразных веществ, так что ΔS2< 0, ΔS3 < 0. При этом ΔS3 имеет более отрицательное значение, чем ΔS2,так как ΔS(H2Oж) <ΔS(H2Oг).
Для энтропии справедливо утверждение: изменение энтропии системы в результате химической реакции (ΔS) равно сумме энтропии продуктов реакции за вычетом суммы энтропии исходных веществ, с учетом числа молей участвующих в реакции веществ.
Функцией состояния, одновременно отражающей влияние обеих вышеупомянутых тенденций на протекание химических процессов, служит энергия Гиббса, связанная с энтальпией и энтропией соотношением:
G = Н - TS, где Т – абсолютная температура.
Энергия Гиббса имеет ту же размерность, что и энтальпия, поэтому выражается обычно в джоулях или килоджоулях. Для изобарно-изотермических процессов изменение энергии Гиббса (или энергия Гиббса реакции) равно сумме энергий Гиббса образования продуктов реакции за вычетом суммы энергий Гиббса образования исходных веществ,суммирование производят с учетом числа молей участвующих в реакции веществ.
Энергию Гиббса образования относят к 1 молю вещества и обычно выражают в кДж/моль; при этом ΔG < 0 образования наиболее устойчивой модификации простого вещества принимают равной нулю.
При постоянстве температуры и давления химические реакции могут самопроизвольно протекать только в таком направлении, при котором энергия Гиббса системы уменьшается (ΔG < 0).
В табл. 2 показана возможность (или невозможность) самопроизвольного протекания реакции при разных сочетаниях знаков ΔS и ΔG.
Термодинамические функции как критерии
самопроизвольного протекания процесса
| ФУНКЦИЯ Определение | S | G |
| dS = Q/T | G = Н - TS | |
| Чем измеряется изменение функции | ΔS = Q/T | а) ΔG = -ΔА b) ΔG = ΔН -ТΔS |
| Условия использования критериев | изолированная система | Т = const Р = const |
| Критерий возможности самопроизвольного процесса | ΔS > 0 | ΔG < 0 |
| Условия равновесия | максимум S ΔS = 0 | минимум G ΔG = 0 |
Значения ΔS и ΔG реакции зависят только от природы реагирующих веществ, но не зависят от их агрегатного состояния и концентраций. Для получения сравнимых данных, характеризующих различные реакции, составляют стандартные изменения энтальпии ΔН, энтропии ΔS и энергии Гиббса ΔG.
Контрольные задания:
1. Напишите термохимическое уравнение реакции взаимодействия растворов серной кислоты и гидроксида натрия. Рассчитайте ее тепловой эффект, используя значения стандартных теплот образования.
2. При сгорании газообразного аммиака образуется монооксид азота и водяной пар. Напишите термохимическое уравнение этой реакции, вычислив ее тепловой эффект в расчете на один моль аммиака.
3. При растворении 1 моль безводного карбоната натрия в большом количестве воды выделяется 25,10 кДж теплоты, тогда как при растворении кристаллогидрата Na2CO3· 10H2O поглощается 66,94 кДж. Вычислите теплоту гидратации Na2CO3.
4. Рассчитайте изменение энтропии (  S) в стандартных условиях для реакции образования аммиака из азота и водорода. По величине
S) в стандартных условиях для реакции образования аммиака из азота и водорода. По величине  S охарактеризуйте изменения состояния системы в процессе реакции.
S охарактеризуйте изменения состояния системы в процессе реакции.
5. Вычислите  S298 системы: Н2 + S (к) = Н2 S(г).
S298 системы: Н2 + S (к) = Н2 S(г).
6. Рассчитайте стандартное изменение энтропии для реакции: CaCO3(т) = CaО(т) + СО2(г).
7. Используя значения  G298 соединений, участвующих в реакции: SiO2(k) + 2NaOH(p) = Na2SiO3(k) + H2O(ж), определите, возможна ли эта реакция.
G298 соединений, участвующих в реакции: SiO2(k) + 2NaOH(p) = Na2SiO3(k) + H2O(ж), определите, возможна ли эта реакция.
8. Определите, какая из реакций характеризуется минимальным значением  G: 4NH3(г) + 3O2(г) = 2N2(г) + 6H2O(г) ; 4NH3(г) + 5O2(г) = 4N2(г) + 6H2O(г) ;
G: 4NH3(г) + 3O2(г) = 2N2(г) + 6H2O(г) ; 4NH3(г) + 5O2(г) = 4N2(г) + 6H2O(г) ;
9. Теплота растворения безводного хлорида стронция равна –47,70 кДж, а теплота растворения кристаллогидрата SrCI2 · 6Н2О равна 30,96 кДж. Вычислите теплоту гидратации SrCI2.
10. Рассчитайте  G298 реакции: СаО(к) + СО2(г) = СаСО3(к) и сделайте вывод о возможности ее протекания.
G298 реакции: СаО(к) + СО2(г) = СаСО3(к) и сделайте вывод о возможности ее протекания.
11. Определите ∆Н0298 процесса термического разложения кальцита СаСО3 массой 0,5 кг.
12. Определите ∆Н0298 процесса окисления SО2 массой 6,4 г кислородом при условии, что реакция окисления прошла полностью.
13. Карбид (ацетиленид) кальция СаС2 получают нагреванием СаО с углем в электропечах: [CaO] + 3[C] = {CaC2] + (CO) ∆Н0298 реакции составляет 462 кДж. Определите ∆Н0 f, 298 [CaC2], используя данные таблицы.
14. Вычислите ∆Н0298 реакции термического разложения карбоната магния массой 10 кг.
15. Определите ∆Н0298 реакции [CaCO3] + (CO2) + {H2O} = {Ca(HCO3)2}, если известно, что масса карбоната кальция, вступившего в нее, составляет 35 г.
16. Сколько теплоты выделится при сжигании 38 г сероуглерода СS2, если его теплота образования ∆Н0 f, 298 = 62,7 кДж/моль?
17. Исходя из реакции SiO2 + 2Mg = 2MgO + Si; ∆Н0298 = -372 кДж вычислить ∆Н0 f, 298(SiO2), приняв ∆Н0 f, 298(MgO) = -611 кДж/моль.
18. Вычислить ∆Н0 f, 298(С3Н8), если известно, что при сгорании 11 г пропана выделилось 552 кДж теплоты.
19. При сгорании 1 л ацетилена (н.у.) выделяется 58,2 кДж. Вычислить ∆Н0 f, 298(С2Н2).
20. Теплоты образования НВr и НI в стандартных условиях соответственно равны -36 и 25,9 кДж/моль. Вычислить их теплоты образования из Вr2(г) и I2(г), принимая Вr2(ж) = Вr2(г); ∆Н0 = 31,0 кДж/моль и I2(т) = I2(г); ∆Н0 = 62,2 кДж/моль.
21. Вычислите DН°298 образования MgCО3, пользуясь следующими данными: С(графит) + О2(газ) = СО2(газ), DН°298 = -393,5 кДж; 2Mg(тв.) + О2(газ)= 2MgO(тв.), DН°298 = -1203,6 кДж; MgO(тв.) + CО2(газ) = MgCO3(тв.), DH°298 = -117,7 кДж.
22. Вычислите, при какой температуре начнется диссоциация пентахлорида фосфора, протекающая по уравнению: PCl5 (газ) = PCl3 (газ) + Cl2 (газ). DН° = +92,59 кДж/моль.
23. DН°298 сгорания бензола С6Н6 ацетилена С2H2 равны -3270 и -1302 кДж/моль соответственно. Определите DН°хр превращения ацетилена в бензол: 3С2Н2 = С6Н6.
24. На основании стандартных теплот образования DН°298 и абсолютных стандартных энтропий DS°298 соответствующих веществ вычислите DG°298 реакции, протекающей по уравнению:С2Н4 (газ) + 3О2 (газ) = 2СО2 (газ) + 2Н2О (ж). Возможна ли эта реакция при стандартных условиях?
25. Определите количество энергии, выделяющееся при гашении 11,2 т СаО, если известно, что тепловой эффект (DН) этой реакции равен 62,7 кДж.
26. Образование сероводорода из простых веществ протекает по уравнению: Н2 (газ) + Sромб = Н2S(газ). DН°298 = -20,15 кДж. Исходя из значений S°298 соответствующих веществ, определите DS°298 и DG°298 для этой реакции. Возможна ли эта реакция при стандартных условиях?
27. При восстановлении 12,7 г оксида меди (II) углеродом (с образованием СО) поглощается 8,24 кДж. Определите DН°298 образования CuO (тв.).
28. Пользуясь данными таблиц, установите, какие из реакций возможны в стандартных условиях: а) N2(газ) + ½ О2(газ)=N2O(газ); б) 4НCl(газ) + О2 (газ) = 2Cl2 (газ) + 2Н2O(ж).
29. При какой температуре наступит равновесие в системе: СО(газ) + 2Н2(газ) ® СН3ОН(жид); DН°298 = -128,05 кДж?
30. Рассчитайте значения DG°298 следующих реакций и установите, в каком направлении они будут протекать самопроизвольно в стандартных условиях:а) Рb(тв) + CuO(тв) = РbО(тв) + Сu(тв); б) NiO(тв) + Pb(тв) = Ni(тв.) + РbО(тв); в) Fe2O3 (тв ) + 3СО(газ) = 2Fе(тв ) + 3СO2 (газ) .
31. Исходя из теплового эффекта реакции: 3CaO(k) + P2O5(k) = Ca3(PO4)2(k); ΔH0 = -739 кДж. Определите ΔH0298 образования ортофосфата кальция.
32. Восстановление Fe3O4 оксидом углерода идет по уравнению: Fe3O4(k) + CO(г) = 3FeO(k) + CO2(г). Вычислите ΔGº298 и сделайте вывод возможности самопроизвольного протекания этой реакции при стандартных условиях.
33. Вычислите ΔНº, ΔSº и ΔGº реакции, протекающей по уравнению: TiO2(k) 2C(k) = Ti(k) + 2CO(г) Возможна ли данная реакция при стандартных условиях?
34. Тепловой эффект какой реакции равен стандартной теплоте образования NO? Вычислите энтальпию образования NO исходя из следующих термодинамических уравнений: 4NH3(г) + 5O2(г) = 4NO(г) + 6H2O(ж) , ΔHº = -1168,80 кДж, 4NH3(г) + 3O2(г) = 2N2(г) + 6H2O(ж), ΔHº = -1530,28 кДж.
35. При сгорании 11,5 г жидкого этилового спирта выделилось 308,71 кДж теплоты. Написать термохимическое уравнение реакции в результате которой образуется диоксид углерода. Вычислить теплоту образования С2Н5ОН(ж).
36. Вычислите стандартную энтальпию образования этана исходя из следующих термохимических уравнений:
С2Н6(г) + 7/2О2(г) = 2СО2(г) + 3Н2О(ж)ΔНº(298К) = -1559,87 кДж
С(к) + О2(г) = СО2(г) ΔНº(298К) = -393,51 кДж
2Н2(г) + О2(г) = 2Н2О(ж) ΔНº(298К) = -571,68 кДж
Тема №8.
Последнее изменение этой страницы: 2016-07-23
lectmania.ru. Все права принадлежат авторам данных материалов. В случае нарушения авторского права напишите нам сюда...