
Категории:
ДомЗдоровьеЗоологияИнформатикаИскусствоИскусствоКомпьютерыКулинарияМаркетингМатематикаМедицинаМенеджментОбразованиеПедагогикаПитомцыПрограммированиеПроизводствоПромышленностьПсихологияРазноеРелигияСоциологияСпортСтатистикаТранспортФизикаФилософияФинансыХимияХоббиЭкологияЭкономикаЭлектроника
Комплексные соединения. Изомерия комплексных соединений. Константа нестойкости и константа устойчивости комплексных ионов.
Комплексные соединения выполняют специфические функции в биологическом окислении, ферментативном катализе, обеспечивают процессы дыхания и фотосинтеза.
Основные понятия и определения:
| Комплексные соединения | - сложные соединения с ковалентными связями, образованными по донорно- акцепторному механизму |
| Комплексообразователь | - центральный атом или ион, имеющий вакантные орбитали. К наиболее распространенным комплексообразователям относятся d- элементы периодической системы |
| Лиганды | - ионы или молекулы, координируемые комплексообразователем |
| Координационное число | - число связей, образованные комплексообразователем с лигандами |
| Дентатность лиганда (Комплексные ёмкость) | - число координационных мест, которое может занимать лиганд |
| Изомерия | - явления, при котором вещества, имеющие одинаковый качественный и количественный состав, различаются строением и, следовательно, свойствами. Виды изомерии: геометрическая, гидратная, ионизационная, координационная. |
| Спектрохимический ряд лигандов | - последовательность лигандов, расположенных в порядке возрастания лигандов на комплексообразователь. |
Лиганды:
| Монодентантные | Бидентантные лиганды | |
| Нейтральные молекулы | Отрицательные ионы | |
| СО – карбонил- NH3 – аммин- Н2О – аква- NO - нитрозил СS - тиокарбонил- | F- - фторо-
Cl-- хлоро-
Br—бромо-
ОН—гидроксо-
CN- - циано-
NO2- -нитро-
NO 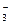 - нитрато-
NCS- - тиоциано-
CH3COO—ацетато-
H- -гидридо- - нитрато-
NCS- - тиоциано-
CH3COO—ацетато-
H- -гидридо-
| СO  - карбонато-
С2O - карбонато-
С2O  - оксалато-
SO - оксалато-
SO  - сульфато-
S2O - сульфато-
S2O  - тиосульфато-
SO - тиосульфато-
SO  - сульфито-
О2- - оксо-
О - сульфито-
О2- - оксо-
О  - пироксо-
H2NCH2CH2NH2(En) – этилендиамино- - пироксо-
H2NCH2CH2NH2(En) – этилендиамино-
|
Номенклатура комплексных соединений:
| Вид комплекса | Координационная формула | Название |
| Катионный | [Ag(NH3)2]CIO4 [Cr(OH2)5CI]CI2 | Перхлорат диамминсеребра (I) Хлорид хлоропентакавахрома (III) |
| Анионный | K2[PtCI6] (NH4)3[Fe(SO3)3] | Гексахлороплатинат (IV) калия Трисульфитофферат (III) аммония |
| Нейтральный | [Co(NH3)3CI3] [Fe(CO)5] | Трихлоротриамминкобальтат пентакарбонилжелезо |
Спектрохимический ряд лигандов:
CN- >СО >NO2- >|En >NH3 >SCN- >Н2О >|ОН- >F-, Cl- >Br- >I-
Сильные лиганды лигады средней силы слабые лиганды
Спаривают электроны не спаривают электроны электроны комплексообразователя
Виды изомерии комплексных соединений:
| Изомерия | Причины изомерии | Примеры |
| Геометрическая | Различное размещение лигандов относительно друг друга | Цис- [Pt(NH3)2CI2] Транс-[Pt(NH3)2CI2] |
| Гидратная | Различное распределение молекул воды между внутренней и внешней сферами | [Cr(OH2)]6CI3 [Cr(OH)2]5CI · H2O [Cr(OH)4 CI2]CI · 2H2O |
| Ионизационная | Различное распределение ионов кислотных осадков между внутренней и внешней сферами | [Co(NH3)5Br]SO4 [Co(NH3)5 SO4] Br |
| Координацион-ная | Различное распределение лигандов между двумя комплексообразователями | [Co(NH3)6] [Cr(CN)6)] [Cr (NH3)6] [Co (CN)6)] |
Электронные структуры и геометрические конфигурации некоторых комплексов:
| Комплекс | Электронная конфигурация комплексообразователя | Тип гибридизац | Геометр. конфигурация комплексов | Магнитные свойства | ||||
| иона | атома | |||||||
| [Cu (NH3)+]+ | 3d104s1 | 3d104s0 | sp | Линейная | диамагнетик | |||
| [Zn(NH3)4]2+ | 3d104s2 | 3d84s0 | sp3 | тетраэдр | диамагнетик | |||
| [Ni(CN)4]2- | 3d84s2 | 3d84s0 | dsp2 | квадрат | диамагнетик | |||
| [NiCI4]2- | 3d84s2 | 3d84s0 | sp3 | тетраэдр | парамагнетик | |||
| [Co(NH3)6]3- | 3d74s2 | 3d64s0 | d2 sp3 | октаидер | диамагнетик | |||
| [CoF]3- | 3d74s2 | 3d64s0 | sp3 d2 | октаидер | парамагнетик | |||
| [Fe(CO)5] | 3d64s2 | 3d64s2 | d sp3 | Тригональная бипирамида | диамагнетик | |||
В водных растворах комплексные соединения диссоциируют. Первичная диссоциация протекает, как у сильных электролитов, практически полностью; при этом образуются комплексный ион и противоположно заряженные ионы внешней сферы:
[Cu(NH3)4]SО4 « [Cu(NH3)4]2+ + SО42-;
K4[Fe(CN)6] « 4K+ + [Fe(CN)6]4-.
Вторичная диссоциация характеризует диссоциацию самого комплексного иона на составляющие его частицы:
[Cu(NH3)4]2+ = Cu2+ + 4NH3;
[Fe(CN)6]4+ = Fe2+ + 6СN-.
Диссоциация комплексного иона протекает в незначительной степени и характеризуется константой равновесия. Эта константа характеризует прочность комплексного иона, и поэтому ее называют константой нестойкости комплексного иона. Для разбираемых примеров выражение константы нестойкости имеет вид: 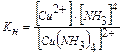 ;
; 
 .
.
Чем меньше Кнест., тем более устойчив данный комплексный ион.
К комплексным солям очень близко примыкают двойные соли. В отличие от комплексных соединений, двойные соли имеют большую константу нестойкости и почти полностью диссоциируют на составляющие их простые ионы.
Последнее изменение этой страницы: 2016-07-23
lectmania.ru. Все права принадлежат авторам данных материалов. В случае нарушения авторского права напишите нам сюда...